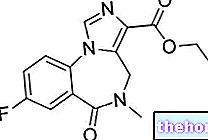
Aktive ingredienser: Folsyre (kalsium N5-metyltetrahydrofolat)
15 mg gastroresistente tabletter
Hvorfor brukes Prefolic? Hva er den til?
FARMAKOTERAPEUTISK KATEGORI
Antianemiske legemidler
TERAPEUTISKE INDIKASJONER
I alle former for folatmangel på grunn av økt etterspørsel, redusert absorpsjon, utilstrekkelig diettinntak.
I antidotisk behandling av overdrevne doser av folsyreantagonister og for å bekjempe bivirkninger forårsaket av aminopterin og metotreksat.
Kontraindikasjoner Når Prefolic ikke skal brukes
Kjent overfølsomhet overfor komponentene.
For intravenøs administrering: samtidig behandling med ceftriaxon hos nyfødte (≤28 dager), selv ved bruk av separate infusjonslinjer. Se avsnittene "Interaksjoner", "Bivirkninger" og "Dose, metode og tidspunkt for administrering".
Forholdsregler for bruk Hva du trenger å vite før du bruker Prefolic
I nærvær av skadelig anemi er det god praksis å knytte vitamin B12 til PREFOLIC for å forhindre nevrologiske komplikasjoner av sykdommen. Hvis PREFOLIC administreres som en langsom dryppløsning, bør langvarig eksponering for oksygen i luften og samtidig administrering av bikarbonater unngås.
Hos epileptiske personer kan antikonvulsive legemidler forårsake en senking av folatemi; administrering av PREFOLIC, mens den motvirker denne effekten, kan øke hyppigheten av tilganger.
Interaksjoner Hvilke medisiner eller matvarer kan endre effekten av Prefolic
For intravenøs administrering: Som med andre kalsiumholdige løsninger, er samtidig behandling med ceftriaxon kontraindisert hos nyfødte (≤ 28 dager), selv ved bruk av separate infusjonslinjer (dødelig risiko for ceftriaxon kalsiumsaltutfelling i strømmen av nyfødte, se avsnittet "Bivirkninger").
Hos pasienter over 28 dager (inkludert voksne) bør ceftriaxon ikke administreres samtidig med intravenøse oppløsninger som inneholder kalsium inkludert Prefolic gjennom samme infusjonslinje (f.eks. Via Y-kontakt).
Hvis den samme linjen brukes til sekvensiell administrering, skal linjen skylles med en kompatibel væske mellom infusjonene.
Advarsler Det er viktig å vite at:
Påvirker evnen til å kjøre bil og bruke maskiner
Det påvirker ikke evnen til å kjøre bil og bruke maskiner.
Dosering og bruksmåte Hvordan bruke Prefolic: Dosering
Hvis det brukes intravenøs administrering, anbefales det å injisere sakte.
Etter oral administrering av PREFOLIC oppnås en blodtopp etter 2-3 timer som deretter forsvinner sakte over tid.
Den gjennomsnittlige dosen av PREFOLIC for både orale og parenterale intramuskulære eller intravenøse ruter kan angis i 15 mg per dag eller annenhver dag i henhold til resept.
Behandlingen med PREFOLIC må forlenges til fullstendig remisjon av folsymptomsymptomer og rekonstituering av den endogene arven. I unntakstilfeller eller ved bruk av PREFOLIC mot antidotisme av antifoliske cytotoksiske legemidler (for eksempel ved administrering av metotreksat med høy dose), kan doseringen innebære bruk av høyere doser, administrert med noen timers mellomrom: 15 mg oralt hver 6.-8. time eller 50-100 mg intravenøst hver 3.-8. time i noen dager i henhold til "redning" -parametrene.
Tablettene er gastro-resistente, det vil si at de frigjør det aktive prinsippet i den proksimale tarmen; de skal ikke tygges, men må svelges hele, helst om morgenen.
Kalsiumsalter kan danne komplekser med mange legemidler, og dette kan føre til dannelse av bunnfall. Fysisk inkompatibilitet er rapportert med ceftriaxon (se avsnitt "Kontraindikasjoner", "Interaksjoner" og "Bivirkninger").
Overdosering Hva du skal gjøre hvis du har tatt for mye Prefolic
Kliniske tilfeller av overdose er ikke kjent så langt.
Bivirkninger Hva er bivirkningene av Prefolic
Ved bruk av produktet er manifestasjoner av overfølsomhet mulig (feber, urtikaria, arteriell hypotensjon, takykardi, bronkospasme, anafylaktisk sjokk). Noen dødelige tilfeller hos premature og fullbårne spedbarn (i alderen <28 dager) som hadde blitt behandlet med intravenøs ceftriaxon og kalsium. Tilstedeværelsen av ceftriaxon-kalsiumsaltutfelling ble påvist post mortem i lunger og nyrer. Den høye risikoen for nedbør hos nyfødte er en konsekvens av deres lave blodvolum og lengre halveringstid for ceftriaxon sammenlignet med voksne ( se avsnittene "Kontraindikasjoner" og "Interaksjoner").
Tilfeller av nyreutfelling har blitt rapportert, hovedsakelig hos barn over 3 år behandlet med høye daglige doser (f.eks. ≥ 80 mg / kg / dag) eller med totaldoser større enn 10 gram og som hadde andre risikofaktorer (f.eks. Væskebegrensning , sengeliggende pasienter). Risikoen for bunndannelse øker hos immobiliserte eller dehydrerte pasienter. Denne hendelsen kan være symptomatisk eller asymptomatisk, kan forårsake nyresvikt og anuri, og er reversibel ved seponering av administrasjonen.
Nedbør av kalsium-ceftriaksonsaltet i galleblæren har blitt observert hovedsakelig hos pasienter behandlet med doser over anbefalt standarddose. Hos barn har prospektive studier vist en variabel forekomst av nedbør med intravenøs administrering; i noen studier var forekomsten større enn 30%. Denne forekomsten ser ut til å være lavere med sakte infusjoner (20-30 minutter). Denne effekten er generelt asymptomatisk, men i sjeldne tilfeller har utfellingene blitt ledsaget av kliniske symptomer, som smerter, kvalme og oppkast. I disse tilfellene anbefales symptomatisk behandling. Nedbør er vanligvis reversibel ved seponering av administrasjonen.
Hvis det oppstår andre bivirkninger enn de som er beskrevet ovenfor, er det tilrådelig å rapportere dem til legen.
Utløp og oppbevaring
Se utløpsdatoen som er angitt på pakningen.
Den angitte utløpsdatoen refererer til produktet i intakt emballasje, riktig lagret.
Advarsel: ikke bruk medisinen etter utløpsdatoen som er angitt på pakningen.
Beskytt mot lys og oppbevar tablettene under 30 ° C.
KVALITATIV OG KVANTITATIV SAMMENSETNING
En 15 mg gastroresistent tablett inneholder: N5-metyltetrahydrofolat kalsiumpentahydrat 19,18 mg tilsvarer 15 mg syre. Hjelpestoffer: maisstivelse, laktose, magnesiumstearat, polyetylenglykol 6000, polymetakrylater, polysorbat 80, simetikon, natriumhydroksid, talkum.
Ett hetteglass med 15 mg pulver inneholder: N5-metyltetrahydrofolat kalsiumpentahydrat 19,18 mg tilsvarende 15 mg syre. Hjelpestoffer: sitronsyre, glutation, mannitt, metyl-p-hydroksybenzoat, natriumhydroksyd.
En ampull med løsningsmiddel inneholder: vann til injeksjonsvæsker.
Ett hetteglass med 50 mg pulver inneholder: N5-metyltetrahydrofolat kalsiumpentahydrat 63,93 mg lik 50 mg syre. Hjelpestoffer: sitronsyre, glutation, mannitt, metyl-p-hydroksybenzoat, natriumhydroksyd.
En ampull med løsningsmiddel inneholder: vann til injeksjonsvæsker.
LEGEMIDDELFORM
30 gastroresistente tabletter på 15 mg
5 hetteglass med 15 mg pulver + 5 hetteglass med 3 ml løsningsmiddel
6 hetteglass med 50 mg pulver + 6 hetteglass med 3 ml løsningsmiddel
Kildepakningsvedlegg: AIFA (Italian Medicines Agency). Innhold publisert i januar 2016. Informasjonen som er tilstede er kanskje ikke oppdatert.
For å få tilgang til den mest oppdaterte versjonen, er det lurt å gå til nettstedet til AIFA (Italian Medicines Agency). Ansvarsfraskrivelse og nyttig informasjon.
01.0 LEGEMIDLETS NAVN
PREFOLISK
02.0 KVALITATIV OG KVANTITATIV SAMMENSETNING
• PREFOLIC 15 tabletter
En mage-resistent tablett inneholder:
Aktivt prinsipp:
Kalsium N5-metyltetrahydrofolatpentahydrat 19,18 mg tilsvarer 15 mg syre.
• PREFOLIC 15 mg / 3 ml pulver og væske til injeksjonsvæske, oppløsning
Ett hetteglass med pulver inneholder:
Aktivt prinsipp:
Kalsium N5-metyltetrahydrofolatpentahydrat 19,18 mg tilsvarer 15 mg syre.
• PREFOLIC 50 mg / 3 ml pulver og væske til injeksjonsvæske, oppløsning
Ett hetteglass med pulver inneholder:
Aktivt prinsipp:
Kalsium N5-metyltetrahydrofolatpentahydrat 63,93 mg lik syre 50 mg.
03.0 LEGEMIDDELFORM
Gastroresistente tabletter.
Hetteglass med pulver + hetteglass med løsningsmiddel.
04.0 KLINISK INFORMASJON
04.1 Terapeutiske indikasjoner
I alle former for folatmangel på grunn av økt etterspørsel, redusert absorpsjon, utilstrekkelig diettinntak.
I antidotisk behandling av overdrevne doser av folsyreantagonister og for å bekjempe bivirkninger forårsaket av aminopterin og metotreksat.
04.2 Dosering og administrasjonsmåte
Etter oral administrering av PREFOLIC oppnås en blodtopp etter 2-3 timer som deretter forsvinner sakte over tid.
Den gjennomsnittlige doseringen av PREFOLIC både oralt og parenteralt intramuskulært eller intravenøst, kan angis i 15 mg daglig eller annenhver dag i henhold til resept.
Behandlingen med PREFOLIC må forlenges til fullstendig remisjon av folsymptomsymptomer og rekonstituering av den endogene arven. I unntakstilfeller eller ved bruk av PREFOLIC mot antidotisme av antifoliske cytotoksiske legemidler (for eksempel ved administrering av metotreksat med høy dose), kan doseringen innebære bruk av høyere doser, administrert med noen timers mellomrom: 15 mg oralt hver 6.-8. time eller 50-100 mg intravenøst hver 3.-8. time i noen dager i henhold til "redning" -parametrene.
04.3 Kontraindikasjoner
Kjent overfølsomhet overfor komponentene.
For intravenøs administrasjon: samtidig behandling med ceftriaxon hos nyfødte (≤28 dager), selv ved bruk av separate infusjonslinjer. Se avsnitt 4.5, 4.8 og 6.2.
04.4 Spesielle advarsler og passende forholdsregler for bruk
Hvis intravenøs administrering brukes, anbefales det å gi injeksjonen sakte. Hos epileptiske pasienter kan antikonvulsive legemidler forårsake en senking av folatemi; administrering av PREFOLIC, samtidig som den motvirker denne effekten, kan øke hyppigheten av tilganger.
Tablettene er gastro-resistente, det vil si at de frigjør det aktive prinsippet i den proksimale tarmen; de skal ikke tygges, men må svelges hele, helst om morgenen.
I nærvær av skadelig anemi er det god praksis å knytte vitamin B12 til PREFOLIC for å forhindre nevrologiske komplikasjoner av sykdommen.
04.5 Interaksjoner med andre legemidler og andre former for interaksjon
For intravenøse administrasjoner: Som med andre kalsiumholdige løsninger, er samtidig behandling med ceftriaxon kontraindisert hos nyfødte (≤28 dager), selv ved bruk av separate infusjonslinjer (dødelig risiko for ceftriaxonsaltutfelling). Kalsium i blodet til nyfødte. (se avsnitt 4.8).
Hos pasienter over 28 dager (inkludert voksne) bør ceftriaxon ikke administreres samtidig med intravenøse oppløsninger som inneholder kalsium inkludert Prefolic gjennom samme infusjonslinje (f.eks. Gjennom en Y -kontakt).
Hvis den samme linjen brukes til sekvensiell administrering, skal linjen skylles med en kompatibel væske mellom infusjonene.
04.6 Graviditet og amming
Dette er en vitaminforbindelse, en normal komponent i organismen vår, uten effekt på mor og foster.
04.7 Påvirkning av evnen til å kjøre bil og bruke maskiner
Det påvirker ikke evnen til å kjøre bil og bruke maskiner.
04.8 Bivirkninger
Ved bruk av produktet er mulige manifestasjoner av overfølsomhet (feber, urticaria, arteriell hypotensjon, takykardi, bronkospasme, anafylaktisk sjokk).
Nedbør av kalsium-ceftriaxonsalt (for intravenøs administrering)
Alvorlige, og i noen tilfeller dødelige, bivirkninger har blitt rapportert sjelden hos premature spedbarn og terminbarn (intravenøst eldret. Tilstedeværelsen av kalsium-ceftriaxonsaltutfelling har blitt påvist post mortem i lunger og nyrer. L "Den høye nedbørsfaren hos nyfødte er en konsekvens av deres lave blodvolum og lengre halveringstid for ceftriaxon sammenlignet med voksne (se pkt. 4.3 og 4.5).
Tilfeller av nyreutfelling har blitt rapportert, hovedsakelig hos barn over 3 år behandlet med høye daglige doser (f.eks. ≥ 80 mg / kg / dag) eller med totaldoser større enn 10 gram og som hadde andre risikofaktorer (f.eks. Væskebegrensning , sengeliggende pasienter). Risikoen for bunndannelse øker hos immobiliserte eller dehydrerte pasienter. Denne hendelsen kan være symptomatisk eller asymptomatisk, kan forårsake nyresvikt og anuri, og er reversibel ved seponering av administrasjonen.
Nedbør av kalsium-ceftriaksonsaltet i galleblæren har blitt observert hovedsakelig hos pasienter behandlet med doser over anbefalt standarddose. Hos barn har prospektive studier vist en variabel forekomst av nedbør med intravenøs administrering; i noen studier var forekomsten større enn 30%. Denne forekomsten ser ut til å være lavere med sakte infusjoner (20-30 minutter). Denne effekten er generelt asymptomatisk, men i sjeldne tilfeller har utfellingene blitt ledsaget av kliniske symptomer, som smerter, kvalme og oppkast. I disse tilfellene anbefales symptomatisk behandling. Nedbør er vanligvis reversibel ved seponering av administrasjonen.
04.9 Overdosering
Kliniske tilfeller av overdose er ikke kjent så langt.
05.0 FARMAKOLOGISKE EGENSKAPER
05.1 Farmakodynamiske egenskaper
Kalsium N5-metyltetrahydrofolat (5-MTHF), et fysiologisk molekyl av vitamin natur, er en aktiv ingrediens som griper inn i dyreorganismer i en rekke viktige reaksjoner, fra det biokjemisk-metabolske synspunkt, som tar sikte på å utføre overføring av karbonmonoksyd -enheten. Blant disse reaksjonene bør spesielt huskes følgende:
til. syntesen av puriner og tymidylat, et vesentlig trinn for biosyntesen av nukleinsyrer;
b. ex novo syntese av labile metyler som starter fra serin, glycin, histidin, formiat;
c. syntesen av metionin med utgangspunkt i homocystein, en reaksjon som krever tilstedeværelse av vitamin B12 som en kofaktor og derfor representerer interaksjonspunktet mellom folat og kobalamin.
05.2 Farmakokinetiske egenskaper
På grunn av dets egenskaper som et fysiologisk molekyl, brukes 5-MTHF av organismen som sådan, uten å gjennomgå ytterligere biotransformasjonsprosesser.Den utgjør den fysiologiske formen for transport av folsyre i plasmaet, hvor den representerer nesten alle de folater som sirkulerer. Det absorberes lett fra fordøyelseskanalen og distribueres derfor til alt vev inkludert CNS; det blir faktisk tatt opp av chorioid plexuses i cerebrospinalvæsken hvor konsentrasjonen er lik tre ganger blodets.
T½ intravenøs 5-MTHF er ca. 2 timer, oralt ca. 2-3 timer. Det elimineres av nyrene og tarmen.
05.3 Prekliniske sikkerhetsdata
06.0 LEGEMIDDELOPPLYSNINGER
06.1 Hjelpestoffer
• PREFOLIC 15 tabletter
Maisstivelse, laktose, magnesiumstearat, polyetylenglykol 6000, polymetakrylater, polysorbat 80, simetikon, natriumhydroksid, talkum.
• PREFOLIC 15 mg / 3 ml pulver og væske til injeksjonsvæske, oppløsning
Sitronsyre, glutation, mannitt, metyl-p-hydroksybenzoat, natriumhydroksid. En ampull med løsningsmiddel inneholder: vann til injeksjonsvæsker.
• PREFOLIC 50 mg / 3 ml pulver og væske til injeksjonsvæske, oppløsning
Sitronsyre, glutation, mannitt, metyl-p-hydroksybenzoat, natriumhydroksid. En ampull med løsningsmiddel inneholder: vann til injeksjonsvæsker.
06.2 Uforlikelighet
Det bør ikke tilsettes løsninger som inneholder bikarbonat.
Kalsiumsalter kan danne komplekser med mange legemidler, og dette kan føre til dannelse av bunnfall. Fysisk inkompatibilitet er rapportert med ceftriaxon (se pkt. 4.3, 4.5 og 4.8).
06.3 Gyldighetsperiode
• PREFOLIC 15 tabletter: 36 måneder
• PREFOLIC 15 mg / 3 ml og PREFOLIC 50 mg / 3 ml, pulver og væske til injeksjonsvæske, oppløsning: 30 måneder
Det rekonstituerte produktet er stabilt i 10 timer.
06.4 Spesielle forholdsregler for lagring
Beskytt mot lys og oppbevar tablettene under 30 ° C.
06.5 Emballasje og innhold i pakningen
- Kartong som inneholder 30 tabletter på 15 mg i blisterpakninger (aluminium-polyeten)
- Kartong som inneholder 5 hermetisk forseglede hetteglass med mørkt glass (gummipropp og metallmetalldeksel) på 15 mg + 5 hetteglass med 3 ml løsemiddel
- Kartong inneholdende 6 hetteglass med mørkt glass med hermetisk lukking (gummipropp og metallmetalldeksel) på 50 mg + 6 hetteglass med 3 ml løsemiddel
06.6 Bruksanvisning og håndtering
Slik åpner du hetteglasset med væske:
- trykk med tommelen over det fargede punktet.
07.0 INNEHAVER AV MARKEDSFØRINGSTILLATELSE
ZAMBON ITALIA s.r.l. - Via Lillo del Duca, 10 - 20091 Bresso (MI)
08.0 NUMMER FOR MARKEDSFØRINGSTILLATELSE
- 30 tabletter à 15 mg - A.I.C.: N. 024703124
- 5 hetteglass med 15 mg pulver + 5 hetteglass med 3 ml løsningsmiddel - A.I.C.: N. 024703098
- 6 hetteglass med 50 mg pulver + 6 hetteglass med 3 ml løsningsmiddel - A.I.C.: N. 024703112
09.0 DATO FOR FØRSTE GODKJENNELSE ELLER FORNYELSE AV GODKJENNINGEN
- 30 tabletter à 15 mg: 20.07.1989
- 5 hetteglass med 15 mg pulver + 5 hetteglass med 3 ml løsningsmiddel: 30.04.1982
- 6 hetteglass med 50 mg pulver + 6 hetteglass med 3 ml løsningsmiddel: 21.02.1985
Fornyelse av autorisasjon: 01.06.2010
10.0 DATO FOR REVISJON AV TEKSTEN
14. januar 2015