Aktive ingredienser: Klaritromycin
Klacid RM 500 mg tabletter med modifisert frigjøring
Klacid pakningsinnsatser er tilgjengelige for pakninger:- Klacid 125 mg / 5 ml granulat til oral suspensjon, Klacid 250 mg / 5 ml - granulat til oral suspensjon, Klacid 500 mg Granulat til oral suspensjon
- Klacid 500 mg / 10 ml Pulver og væske til infusjonsvæske, oppløsning
- Klacid 250 mg tabletter, Klacid 500 mg tabletter
- Klacid RM 500 mg tabletter med modifisert frigjøring
Hvorfor brukes Klacid? Hva er den til?
FARMAKOTERAPEUTISK KATEGORI
Generell antibakteriell for systemisk bruk - Makrolider.
TERAPEUTISKE INDIKASJONER
Behandling av infeksjoner forårsaket av patogener som er følsomme for klaritromycin.
Infeksjoner i neshorn-faryngealet (tonsillitt, faryngitt), i paranasale bihuler.
Nedre luftveisinfeksjoner: bronkitt, bakteriell lungebetennelse og atypisk lungebetennelse.
Hudinfeksjoner: impetigo, erysipelas, follikulitt, furunkulose og infiserte sår.
Klacid 500 mg tabletter med modifisert frisetting er indisert hos voksne og barn over 12 år.
Klacid 125 mg / 5 ml granulat til oral suspensjon og Klacid 250 mg / 5 ml granulat til oral suspensjon er indikert hos barn fra 6 måneder til 12 år.
Kontraindikasjoner Når Klacid ikke skal brukes
Overfølsomhet overfor antibiotika i makrolidklassen eller overfor noen av hjelpestoffene listet opp i avsnittet "Sammensetning"
Samtidig administrering av klaritromycin med noen av følgende medisiner er kontraindisert: astemizol, cisaprid, pimozid, terfenadin, ettersom de kan indusere forlengelse av QT -intervallet og hjertearytmi, inkludert ventrikulær takykardi, ventrikkelflimmer og torsades de pointes.
Samtidig administrering av klaritromycin med ticagrelor eller ranolazin er kontraindisert.
Samtidig administrering av klaritromycin og ergotalkaloider (ergotamin eller dihydroergotamin) som kan føre til ergotoksisitet er kontraindisert (se avsnitt "Interaksjoner").
Samtidig administrering av klaritromycin og midazolam til oral bruk er kontraindisert (se avsnitt "Interaksjoner").
Klacid bør ikke brukes til pasienter med medfødt eller ervervet QT -intervallforlengelse dokumentert og som tidligere har hatt ventrikulær arytmi (se avsnitt "Spesielle advarsler").
Klacid må ikke administreres samtidig med HMG-CoA reduktasehemmere (statiner), som metaboliseres i stor utstrekning av CYP3A4 (lovastatin og simvastatin) på grunn av økt risiko for myopati, inkludert rabdomyolyse (se avsnitt "Interaksjoner").
Klacid må ikke gis til pasienter med hypokalemi (risiko for forlengelse av QT -intervallet).
Klacid må ikke brukes til pasienter som lider av alvorlig leversvikt forbundet med nyreskade.
Som med andre potente hemmere av CYP3A4 -enzymet, bør klaritromycin ikke brukes samtidig med kolkisin (se avsnitt "Spesielle advarsler").
Forholdsregler for bruk Hva du trenger å vite før du bruker Klacid
Siden klaritromycin metaboliseres og utskilles hovedsakelig i leveren, bør det utvises særlig forsiktighet ved administrering av legemidlet til pasienter med nedsatt leverfunksjon og hos personer med moderat eller alvorlig nedsatt nyrefunksjon.
Dødelige tilfeller av leversvikt er rapportert ved bruk av klaritromycin. Noen pasienter kan ha hatt tidligere leversykdom eller tatt andre hepatotoksiske legemidler.
Pasienten bør rådes til å avslutte behandlingen og kontakte legen hvis tegn og symptomer på leversykdom som anoreksi, gulsott, mørk urin, kløe eller magesmerter oppstår.
Tilfeller av pseudomembranøs kolitt er rapportert ved bruk av nesten alle antibakterielle midler, inkludert makrolider, alt fra moderat til livstruende. Tilfeller av Clostridium difficile diaré (CDAD) er rapportert. Ved bruk av de fleste antibakterielle midler, inkludert klaritromycin, som kan variere fra moderat diaré til dødelig kolitt. Antibakteriell behandling endrer normal tarmflora, noe som kan føre til overdreven spredning av C. difficile.
Hos alle pasienter som klager over diaré etter å ha tatt antibiotika, bør tilstedeværelsen av CDAD evalueres. Disse pasientene bør gjennomgå en grundig medisinsk historie siden det har blitt rapportert at CDAD kan forekomme i løpet av de to månedene etter inntak av antibakterielle midler. Derfor bør seponering av klaritromycinbehandling skje uavhengig av terapeutisk indikasjon. En mikrobiell test bør utføres og passende behandling startes. Administrering av antiperistaltiske midler bør unngås.
Interaksjoner Hvilke medisiner eller matvarer kan endre effekten av Klacid
Fortell legen din eller apoteket dersom du nylig har tatt andre legemidler, også reseptfrie.
Bruk av følgende medisiner er absolutt kontraindisert på grunn av potensielle alvorlige effekter på grunn av legemiddelinteraksjonen: astemizol, cisaprid, pimozid, terfenadin.
Samtidig inntak resulterte i forlenget QT -intervall, hjertearytmier inkludert ventrikulær takykardi, ventrikkelflimmer og torsades de pointes (se "Kontraindikasjoner").
Noen rapporter etter markedsføring indikerer at samtidig administrering av klaritromycin og ergotamin eller dihydroergotamin har vært assosiert med akutt ergotoksisitet (ergotisme) preget av vasospasme og iskemi i ekstremiteter og andre vev, inkludert sentralnervesystemet. Samtidig administrering av klaritromycin og ergotalkaloider er kontraindisert (se avsnitt "Kontraindikasjoner").
Samtidig bruk av klaritromycin og lovastatin eller simvastatin er kontraindisert da disse statinene metaboliseres i stor utstrekning av CYP3A4 og samtidig behandling med klaritromycin øker plasmakonsentrasjonen, noe som øker risikoen for myopati, inkludert rabdomyolyse (se avsnitt "Kontraindikasjoner").
Det har vært rapporter om rabdomyolyse hos pasienter som tar klaritromycin samtidig med disse statinene. Hvis behandling med klaritromycin ikke kan unngås, bør behandling med lovastatin eller simvastatin avbrytes under behandlingen.
Vær forsiktig når du foreskriver klaritromycin med statiner. I situasjoner der samtidig bruk av klaritromycin og statiner ikke kan unngås, anbefales det å foreskrive den laveste registrerte dosen statiner Muligheten for å bruke et statin som ikke er avhengig av CYP3A -metabolisme (f.eks. Fluvastatin). Pasienter bør overvåkes for tegn og symptomer på myopati.
Andre legemidlers virkning på klaritromycin:
Legemidler som induserer CYP3A (f.eks. Rifampicin, fenytoin, karbamazepin, fenobarbital, johannesurt) kan indusere metabolismen av klaritromycin. Dette fører til subterapeutiske nivåer av klaritromycin med redusert terapeutisk effekt. Legemidler som er sterke induktorer for cytokrom P450-metabolisme som efavirenz, nevirapin, rifampicin, rifabutin og rifapentin kan akselerere metabolismen av klaritromycin og følgelig senke plasmanivåene av klaritromycin, mens øke plasmanivåene av 14-OH-klaritromycin, en metabolitt som også er aktiv fra et mikrobiologisk synspunkt.
En farmakokinetisk studie har vist at samtidig administrering av 200 mg ritonavir hver 8. time og 500 mg klaritromycin hver 12. time fører til markert hemming av metabolismen av klaritromycin. Fullstendig inhibering av 14-OH-klaritromycindannelse ble notert.
Eksponering for klaritromycin ble redusert med etravirin; konsentrasjonen av den aktive metabolitten, 14-OH-klaritromycin, ble imidlertid økt. Siden 14-OH-klaritromycin har redusert aktivitet mot Mycobacterium Avium Complex (MAC), kan den generelle aktiviteten mot dette patogenet endres, derfor bør alternativer til klaritromycin vurderes for behandling av MAC.
Samtidig administrering av flukonazol 200 mg daglig og klaritromycin 500 mg to ganger daglig til 21 friske frivillige resulterte i økninger i gjennomsnittlig minimumsklaritromycinkonsentrasjon (Cmin) og areal under kurven (AUC).) På henholdsvis 33% og 18%. Basalkonsentrasjonene av den aktive metabolitten, 14-OH-klaritromycin, ble ikke signifikant påvirket av samtidig administrering av flukonazol. Ingen dosejustering av klaritromycin er nødvendig.
Effekter av klaritromycin på andre legemidler:
Samtidig administrering av klaritromycin, som er kjent for å hemme CYP3A, og et stoff som hovedsakelig metaboliseres av CYP3A, kan være forbundet med økning i legemiddelkonsentrasjoner som kan potensere eller forlenge de terapeutiske og bivirkningene av legemidlet administrert samtidig.
Klaritromycin bør brukes med forsiktighet hos pasienter som får behandling med andre legemidler som antas å være substrater for CYP3A -enzymet, spesielt hvis CYP3A -substratet har en smal sikkerhetsmargin (f.eks. Karbamazepin) og / eller hvis substratet metaboliseres i stor grad av dette enzym.
Dosejusteringer bør vurderes, og når det er mulig, bør serumkonsentrasjoner av legemidler som hovedsakelig metaboliseres av CYP3A overvåkes nøye hos pasienter som får samtidig klaritromycinbehandling.
Legemidler eller legemiddelklasser som er kjent eller antas å metaboliseres av det samme CYP3A -isozymet er: alprazolam, orale antikoagulantia (f.eks. Warfarin), astemizol, karbamazepin, cilostazol, cisaprid, cyklosporin, disopyramid, ergotalkaloider, lovastamolon, metylprednisid, metylprednis, rifabutin, sildenafil, simvastatin, sirolimus, takrolimus, terfenadin, triazolam og vinblastine, men denne listen er ikke fullstendig.
Andre legemidler som interagerer med en lignende mekanisme i cytokrom P450 -systemet er fenytoin, teofyllin og valproat. Tilfeller av forhøyede serumnivåer er rapportert.
Andre tilfeller av torsades de pointes er rapportert etter samtidig bruk av klaritromycin og kinidin eller disopyramid. Følg serumkonsentrasjonen av disse legemidlene under bruk i klaritromycinbehandling.
Tilfeller av hypoglykemi er rapportert etter samtidig bruk av klaritromycin og disopyramid. Følg blodsukkernivået under behandlingen.
Ved samtidig bruk av klaritromycin med visse hypoglykemiske legemidler som nateglinid og repaglinid, kan hemming av CYP3A -enzymet av klaritromycin forekomme og kan forårsake hypoglykemi. Det anbefales å følge nøye med på glukosenivået.
Omeprazol
Friske voksne personer fikk klaritromycin (500 milligram hver 8. time) i kombinasjon med omeprazol (40 milligram daglig). Plasmakonsentrasjonen av omeprazol ved baseline ble økt (Cmax, AUC0-24 og T1 / 2 økes med 30%, 89% og 34 henholdsvis % på grunn av samtidig administrering av klaritromycin.
Gjennomsnittlig gastrisk pH -verdi over 24 timer var 5,2 når omeprazol ble administrert alene, og var 5,7 når omeprazol ble administrert samtidig med klaritromycin.
Sildenafil, tadalafil og vardenafil
Hver av disse fosfodiesterasehemmerne metaboliseres, i det minste delvis, av CYP3A og CYP3A kan hemmes ved samtidig administrering av klaritromycin. Samtidig administrering av klaritromycin og sildenafil, tadalafil eller vardenafil vil med stor sannsynlighet føre til økt eksponering for fosfodiesterasehemmeren. Derfor bør en reduksjon i dosen av sildenafil, tadalafil og vardenafil vurderes når disse legemidlene administreres samtidig med klaritromycin.
Resultater av kliniske studier har vist at plasmanivåene av karbamazepin og teofyllin kan gjennomgå en beskjeden, men statistisk signifikant økning når disse administreres samtidig med klaritromycin.
Tolterodina
Den viktigste metabolske veien for tolterodin passerer gjennom 2D6 -isoformen til cytokrom P450 (CYP2D6), men i en populasjonsundermengde uten CYP2D6 er den identifiserte metabolske veien CYP3A. I denne populasjonsundergruppen, hemmer CYP3A. .I nærvær av CYP3A -hemmere kan en dosereduksjon av tolterodin være nødvendig, samt en dosereduksjon av klaritromycin i pasientpopulasjonen der CYP2D6 metaboliseres dårlig.
Andre legemiddelinteraksjoner:
Forsiktighet anbefales ved samtidig administrering av klaritromycin og andre ototoksiske legemidler, spesielt aminoglykosider (se avsnitt "Advarsler").
Kolkisin er et substrat for både CYP3A og utstrømningstransportøren P-glykoprotein (Pgp). Klaritromycin og andre makrolider er kjent for å hemme CYP3A og Pgp. Når klaritromycin og kolkisin administreres samtidig, kan hemming av CYP3A og / eller Pgp av klaritromycin økt eksponering for kolkisin. Overvåk pasienter for kliniske symptomer på kolkisintoksisitet (se avsnittet "Forholdsregler for bruk").
Pasienter på klaritromycin og digoksinbehandling har vist økte serumkonsentrasjoner av sistnevnte; derfor bør digoksinnivåer overvåkes.
Samtidig administrering av klaritromycintabletter og zidovudin til voksne pasienter med HIV -infeksjoner kan resultere i en reduksjon i steady state zidovudinkonsentrasjon.
Siden klaritromycin ser ut til å forstyrre absorpsjonen av samtidig administrert oralt administrert zidovudin, kan denne interaksjonen sterkt unngås ved å forskyve dosene av klaritromycin og zidovudin for å gi et intervall på minst 4 timer.
Denne interaksjonen forekommer ikke hos pediatriske pasienter med HIV -infeksjoner når klaritromycin tas i granulatform samtidig med zidovudin eller didanosin.
Fenytoin og valproat:
Det har vært spontane eller publiserte rapporter om interaksjoner mellom CYP3A -hemmere, inkludert klaritromycin, med legemidler som ikke anses å metaboliseres av CYP3A (f.eks. Fenytoin og valproat). Serumnivåbestemmelser anbefales for disse legemidlene når de administreres samtidig med klaritromycin. Tilfeller av forhøyede serumnivåer er rapportert.
Toveis legemiddelinteraksjoner:
Klaritromycin og atazanavir, som itrakonazol og saquinavir, er substrater og hemmere av CYP3A, og det er tegn på toveis legemiddelinteraksjoner mellom disse legemidlene.
Forsiktighet utvises ved samtidig administrering av klaritromycin og kalsiumkanalblokkere som metaboliseres av CYP3A4 (f.eks. Verapamil, amlodipin, diltiazem) på grunn av risikoen for hypotensjon. Plasmakonsentrasjoner av klaritromycin så vel som for kalsiumkanalblokkere kan øke på grunn av interaksjonen.Hypotensjon, bradyarytmi og melkesyreacidose er observert hos pasienter som tar klaritromycin og verapamil samtidig.
Advarsler Det er viktig å vite at:
Forsiktighet bør utvises hos pasienter med alvorlig nyreinsuffisiens (se avsnitt "Dose, metode og tidspunkt for administrering"). Siden klaritromycin hovedsakelig utskilles i leveren, bør det utvises særlig forsiktighet ved administrering av antibiotika til pasienter med nedsatt leverfunksjon og hos personer med moderat eller alvorlig nedsatt nyrefunksjon. Det er rapportert fatale tilfeller av leversvikt.
Plasmanivåene av klaritromycin ser ikke ut til å bli nevneverdig endret ved hemodialyse eller peritonealdialyse.
Bruk av de fleste antibakterielle midler, inkludert makrolider, kan forårsake pseudomembranøs kolitt og mild til svært alvorlig Clostridium difficile diaré. Det har vært rapporter etter markedsføring om kolkisintoksisitet ved samtidig bruk av kolkisin og klaritromycin, spesielt hos eldre pasienter, noen av de rapporterte tilfellene forekom hos pasienter med nyreinsuffisiens. Dødsfall er rapportert hos noen av disse pasientene (se avsnitt "Interaksjoner ").
Samtidig administrering av klaritromycin og kolkisin er kontraindisert (se avsnitt "Kontraindikasjoner").
Forsiktighet anbefales ved samtidig administrering av klaritromycin og triazolobenzodiazepiner, for eksempel triazolam og injiserbart midazolam (se avsnitt "Interaksjoner").
Forsiktighet anbefales ved samtidig administrering av klaritromycin og andre ototoksiske legemidler, spesielt aminoglykosider. Det er derfor tilrådelig å periodisk overvåke vestibulær og auditiv funksjon under og etter behandling.
På grunn av risikoen for forlengelse av QT -intervallet, bør klaritromycin brukes med forsiktighet hos pasienter med koronarsykdom, alvorlig hjertesvikt, hypomagnesemi, bradykardi (
I påvente av resistens mot Streptococcus pneumoniae mot makrolider, er det viktig å utføre en sensitivitetstest før du foreskriver klaritromycin for behandling av pneumoni i samfunnet.Nosokomial lungebetennelse bør klaritromycin administreres i kombinasjon med passende antibiotika.
Middels til moderat hud- og bløtvevsinfeksjoner er oftest forårsaket av Staphylococcus aureus og Streptococcus pyogenes, som begge kan være resistente mot makrolider. Deretter er det nødvendig å utføre en sensitivitetstest. I tilfeller der beta-laktamantibiotika ikke kan brukes (f.eks. Allergi), er det å foretrekke å bruke andre antibiotika, for eksempel clindamycin.
Ved alvorlige akutte overfølsomhetsreaksjoner som anafylaksi, Stevens-Johnsons syndrom, toksisk epidermal nekrolyse og DRESS syndrom, bør behandling med klaritromycin seponeres umiddelbart og passende behandling vedtas umiddelbart.
Samtidig bruk av klaritromycin og lovastatin eller simvastatin er kontraindisert (se avsnitt "Kontraindikasjoner"). Vær forsiktig når du foreskriver klaritromycin med andre statiner. Rabdomyolyse er rapportert hos pasienter som tar klaritromycin og statiner. Pasienter bør overvåkes for tegn og symptomer på myopati. I situasjoner der samtidig bruk av klaritromycin og statiner ikke kan unngås, anbefales det å foreskrive den laveste registrerte dosen statiner. Muligheten for å bruke et statin som ikke er avhengig av metabolismen av CYP3A -enzymet (f.eks. Fluvastatin) kan vurderes (se avsnitt "Interaksjoner").
"Samtidig bruk av klaritromycin og orale hypoglykemiske midler (som sulfonylurinstoffer) og / eller insulin kan føre til alvorlig hypoglykemi. C" er risikoen for alvorlig blødning og en betydelig økning i det internasjonale normaliserte forholdet (INR) og protrombintid når klaritromycin er administreres samtidig med warfarin (se avsnitt "Interaksjoner"). Langvarig bruk av stoffet, på samme måte som det som skjer med andre antibiotika, kan forårsake superinfeksjoner fra resistente bakterier eller sopp. Skulle superinfeksjoner utvikle seg, bør behandlingen avbrytes og passende behandling startes umiddelbart. Det bør tas hensyn til muligheten for kryssresistens mellom klaritromycin og andre makrolider, linkomycin og klindamycin.
Viktig informasjon om noen av hjelpestoffene
Klacid RM 500 mg tabletter med modifisert frigjøring inneholder laktose. Pasienter som har blitt diagnostisert med en "intoleranse for noen sukkerarter" bør kontakte legen sin før de tar denne medisinen.
Legemidlet er ikke kontraindisert for personer med cøliaki.
Graviditet og amming
Rådfør deg med lege eller apotek før du tar medisiner.
Klaritromycin bør ikke forskrives til gravide uten en "grundig vurdering av risiko / nytte, spesielt i første trimester av svangerskapet (se avsnitt" Spesielle advarsler ").
Klaritromycin skilles ut i morsmelk i slike mengder at det er sannsynlig at det påvirker nyfødte / spedbarn.
Påvirker evnen til å kjøre bil og bruke maskiner
Det er ingen data om effekten av klaritromycin på evnen til å kjøre bil eller bruke maskiner. Risikoen for svimmelhet, svimmelhet, forvirring og desorientering, som kan oppstå etter administrering, må vurderes før pasienten kjører eller bruker maskiner.
Dosering og bruksmåte Hvordan bruke Klacid: Dosering
Voksne og barn over 12 år
Den anbefalte dosen Klacid RM 500 mg tabletter med modifisert frisetting hos voksne og barn over 12 år er 1 tablett per dag som skal tas til måltider. Ved mer alvorlige infeksjoner kan dosen økes opp til 2500 mg modifisert -slipp tabletter per dag som skal tas i en enkelt administrasjon.
Tablettene skal svelges hele.
Vanlig behandlingstid er 5 til 14 dager, eksklusiv behandling for pneumoni og bihulebetennelse i samfunnet som tar 6 til 14 dager.
Barn i alderen 6 måneder til 12 år
Bruk av Klacid -tabletter er ikke undersøkt hos barn under 12 år som trenger å ta den pediatriske suspensjonen (granulat til oral suspensjon).
Klacid RM bør ikke gis til pasienter med nyreinsuffisiens hvis kreatininclearance er mindre enn 30 ml / min. Klacid tabletter med umiddelbar frigjøring kan brukes i denne pasientpopulasjonen.
Overdosering Hva du skal gjøre hvis du har tatt for mye Klacid
Ved utilsiktet inntak / inntak av overdreven dose Klacid, må du varsle legen din umiddelbart eller gå til nærmeste sykehus.
Gastrointestinale forstyrrelser kan oppstå når høye doser klaritromycin tas.
Bivirkninger som oppstår ved overdosering bør behandles med øyeblikkelig eliminering av det ikke -absorberte legemidlet og med passende støttende behandlinger. Som med andre makrolider elimineres ikke serumnivået av klaritromycin ved hemodialyse eller peritonealdialyse, derfor er det nødvendig å gripe inn som snarest mulig prøver å eliminere stoffet som ennå ikke er absorbert ved å handle samtidig med passende symptomatisk terapi.
Spør lege eller apotek hvis du har spørsmål om bruk av Klacid.
Bivirkninger Hva er bivirkningene av Klacid
Som alle andre legemidler kan Klacid forårsake bivirkninger, men ikke alle får det. De rapporterte bivirkningene for Klacid er listet opp nedenfor.
til. Oppsummering av sikkerhetsprofilen
De hyppigste og vanligste bivirkningene knyttet til klaritromycinbehandling for både voksne og barn er magesmerter, diaré, kvalme, oppkast og smakperversjon. Disse bivirkningene er vanligvis av middels intensitet og er i samsvar med den kjente sikkerhetsprofilen for makrolidantibiotika.
Det er ingen signifikant forskjell i forekomsten av disse gastrointestinale bivirkningene under kliniske studier mellom pasienter med eller uten eksisterende mykobakterielle infeksjoner.
b. Sammendragstabell over bivirkninger
Tabellen nedenfor oppsummerer bivirkninger rapportert under kliniske studier og erfaring etter markedsføring med klaritromycin tabletter med umiddelbar frigjøring, granulat til oral suspensjon og modifiserte frigivelsestabletter.
Bivirkninger som anses muligens relatert til klaritromycin rapporteres etter organtype og frekvens, i henhold til følgende konvensjon: svært vanlige (≥1 / 10), vanlige (≥1 / 100,
* Siden disse reaksjonene er rapportert frivillig fra en befolkning med en ubestemt størrelse, er det ikke alltid mulig å foreta et sant estimat av frekvensen eller etablere et årsak og virkning-forhold til legemiddeleksponering. Pasienteksponering overstiger en milliard dager pasient behandling med klaritromycin
** I noen av de rapporterte tilfellene av rabdomyolyse ble klaritromycin administrert samtidig med statiner, fibrater, kolkisin eller allopurinol.
1 Bivirkning rapportert kun for pulver og væskeformulering til infusjonsvæske, oppløsning
2 Bivirkning rapportert kun for granulat til oral suspensjon
3 Bivirkning rapportert kun for tablettformulering med umiddelbar frigjøring
4,6,8,9 Se avsnitt a)
5,7,10 Se avsnitt c)
c. Beskrivelse av utvalgte bivirkninger
I noen av de rapporterte tilfellene av rabdomyolyse ble klaritromycin administrert samtidig med statiner, fibrater, kolkisin eller allopurinol.
Etter markedsføring av legemiddelinteraksjoner og effekter på sentralnervesystemet (CNS) (f.eks. Søvnighet og forvirring) er rapportert ved samtidig bruk av klaritromycin og triazolam Det foreslås at pasienten overvåkes for økte farmakologiske effekter på CNS-nivå.
Sjeldne tilfeller av klaritromycin modifiserte frigivelsestabletter i avføring er rapportert, hvorav de fleste forekom hos pasienter med anatomiske endringer (inkludert ileostomi eller kolostomi) eller gastrointestinale funksjonsforstyrrelser med forkortet gastrointestinal transittid. I flere tilfeller har tablettrester forekommet i forbindelse med diaré. For de pasientene som har opplevd tilstedeværelse av tablettrester i avføringen og ingen forbedring i tilstanden, anbefales det å bytte til en annen formulering av klaritromycin (f.eks. Oral suspensjon) eller et annet antibiotika.
Rapportering av bivirkninger
Rådfør deg med lege eller apotek dersom du får bivirkninger, inkludert mulige bivirkninger som ikke er nevnt i dette pakningsvedlegget. Uønskede effekter kan også rapporteres direkte via det nasjonale rapporteringssystemet på "www.agenziafarmaco.gov.it/it/responsabili". Ved å rapportere bivirkninger kan du bidra med mer informasjon om sikkerheten til dette legemidlet. "
Utløp og oppbevaring
Utløpsdato: Se utløpsdatoen som er angitt på pakken. Utløpsdatoen angitt refererer til produktet i intakt emballasje, riktig lagret.
Denne medisinen krever ingen spesielle oppbevaringsbetingelser.
ADVARSEL: Ikke bruk medisinen etter utløpsdatoen som er angitt på pakningen. Medisiner bør ikke kastes i avløpsvann eller husholdningsavfall. Spør apoteket om hvordan du skal kaste medisiner du ikke bruker lenger. Dette vil bidra til å beskytte miljøet.
Hold denne medisinen utilgjengelig for barn
Sammensetning og farmasøytisk form
SAMMENSETNING:
Hver tablett med modifisert utgivelse inneholder:
Aktiv ingrediens: Klaritromycin 500 mg;
Hjelpestoffer: Vannfri sitronsyre, natriumalginat, natrium- og kalsiumalginat, laktose, povidon K30, talkum, stearinsyre, magnesiumstearat, hypromellose 6 cps, makrogol 400, makrogol 8000, titandioksid (E-171), sorbinsyre, kinolingult ( E-104).
LEGEMIDDELFORM OG INNHOLD
Modifiserte tabletter til oral bruk - Blisterpakninger med 7 tabletter à 500 mg.
Kildepakningsvedlegg: AIFA (Italian Medicines Agency). Innhold publisert i januar 2016. Informasjonen som er tilstede er kanskje ikke oppdatert.
For å få tilgang til den mest oppdaterte versjonen, er det lurt å gå til nettstedet til AIFA (Italian Medicines Agency). Ansvarsfraskrivelse og nyttig informasjon.
01.0 LEGEMIDLETS NAVN
KLACID
02.0 KVALITATIV OG KVANTITATIV SAMMENSETNING
• Klacid 250 mg belagte tabletter:
Hver belagt tablett inneholder:
Aktivt prinsipp:
klaritromycin 250 mg
Natriuminnhold: 3,4 mg per tablett
• Klacid 500 mg tabletter:
Hver belagt tablett inneholder:
Aktivt prinsipp:
klaritromycin 500 mg
Natriuminnhold: 6,1 mg per tablett
- Klacid 125 mg / 5 ml Granulat til oral suspensjon:
100 ml rekonstituert suspensjon inneholder:
Aktivt prinsipp:
klaritromycin 2,50 g
Hjelpestoffer med kjent effekt: sukrose 550 mg / ml
ricinusolje 3,2 mg / ml
- Klacid 250 mg / 5 ml Granulat til oral suspensjon:
100 ml rekonstituert suspensjon inneholder:
Aktivt prinsipp:
klaritromycin 5,00 g
Hjelpestoffer med kjent effekt: sukrose 455 mg / ml
ricinusolje 6,4 mg / ml
• Klacid 250 mg granulat til oral suspensjon:
Hver pose inneholder:
Aktivt prinsipp:
klaritromycin 250 mg
Hjelpestoffer med kjent effekt: 1591 mg sukrose per pose
ricinusolje 32,1 mg per pose
• Klacid 500 mg granulat til oral suspensjon:
Hver pose inneholder:
Aktivt prinsipp:
klaritromycin 500 mg
Hjelpestoffer med kjent effekt: sukrose 3182 mg per pose
ricinusolje 64,2 mg per pose
• Klacid 500 mg / 10 ml Pulver og væske til infusjonsvæske, oppløsning:
Hvert hetteglass med sterilt pulver til infusjonsvæske, oppløsning inneholder:
Aktivt prinsipp
klaritromycin 500 mg
• Klacid RM 500 mg tabletter med modifisert utgivelse:
Hver tablett med modifisert utgivelse inneholder:
Aktivt prinsipp:
klaritromycin 500 mg
Natriuminnhold: 15,3 mg per tablett
Hjelpestoffer med kjent effekt: laktose (115 mg per tablett)
For fullstendig liste over hjelpestoffer, se pkt.6.1
03.0 LEGEMIDDELFORM
• Belagte tabletter.
• Granulat for oral suspensjon.
• Pulver og væske til infusjonsvæske, oppløsning.
• Tabletter med modifisert utgivelse.
04.0 KLINISK INFORMASJON
04.1 Terapeutiske indikasjoner
Offisiell veiledning om riktig bruk av antibakterielle midler bør vurderes.
Klacid er indisert hos voksne og barn over 12 år.
Klacid 125 mg / 5 ml granulat til oral suspensjon og Klacid 250 mg / 5 ml granulat til oral suspensjon er indikert hos barn fra 6 måneder til 12 år.
For alle farmasøytiske former:
Behandling av infeksjoner forårsaket av patogener som er følsomme for klaritromycin. Infeksjoner i neshorn-faryngealet (tonsillitt, faryngitt), i paranasale bihuler. Nedre luftveisinfeksjoner: bronkitt, bakteriell lungebetennelse og atypisk lungebetennelse. Hudinfeksjoner: impetigo, erysipelas, follikulitt, furunkulose og infiserte sår.
Videre for Klacid 125 mg / 5 ml granulat til oral suspensjon og for Klacid 250 mg / 5 ml granulat til oral suspensjon:
Akutt mellomørebetennelse (AOM).
Også for Klacid 250 mg tabletter og for Klacid 250 mg Granulat til oral suspensjon:
Akutte og kroniske odontostomatologiske infeksjoner påført av følsomme bakterier.
Videre for Klacid 500 mg belagte tabletter, for Klacid 250 mg Granulat til oral suspensjon og for Klacid 500 mg Granulat til oral suspensjon:
Lokaliserte eller diffuse mykobakterielle infeksjoner forårsaket av Mycobacterium avium eller Mycobacterium intracellulare.
Lokaliserte infeksjoner pga Mycobacterium chelonae, fortuitum eller kansasii.
Klaritromycin, i nærvær av reduksjon av magesyre, er indikert i "utryddelse av"Helicobacter pylori, som produserer en påfølgende nedgang i gjentakelse av magesåret.
04.2 Dosering og administrasjonsmåte
Hos barn over 12 år: som for voksne.
Vanlig behandlingstid er 5 til 14 dager, eksklusiv behandling for pneumoni og bihulebetennelse i samfunnet som tar 6 til 14 dager.
Hos barn under 12 år: bruk Klacid 125 mg / 5 ml Granulat til oral suspensjon eller Klacid 250 mg / 5 ml Granulat til oral suspensjon.
Vanlig behandlingstid er 5 - 10 dager.
Bruk av Klacid Coated Tablets, Klacid Modified Release Tablets eller Klacid Powder and Solvent for Infusion Solution anbefales ikke til barn under 12 år.
Klacid 250 mg tabletter, Klacid 500 mg tabletter, Klacid 250 mg granulater til oral suspensjon og Klacid 500 mg granulat til oral suspensjon:
Den anbefalte dosen klaritromycin til voksne og barn over 12 år er 1 tablett eller 1 pose 250 mg hver 12. time.
Ved alvorlige infeksjoner kan dosen økes opp til 500 mg hver 12. time.
Vanlig behandlingstid er 5 til 14 dager, eksklusiv behandling for pneumoni og bihulebetennelse i samfunnet som tar 6 til 14 dager.
Pasienter med nedsatt nyrefunksjon: Hos pasienter med nyreinsuffisiens hvor kreatininclearance er mindre enn 30 ml / min, bør dosen reduseres med halvparten, for eksempel 250 mg én gang daglig eller 250 mg to ganger daglig ved alvorlige infeksjoner.
Hos slike pasienter bør administrasjonen ikke fortsette utover 14 dager.
Hos pasienter med mykobakterielle infeksjoner er startdosen 500 mg to ganger daglig. Hvis det ikke oppstår noen klinisk forbedring eller bakteriologiske bevis innen 3-4 uker, kan den daglige dosen økes til 1000 mg to ganger daglig.
Det anbefales ved behandling av infeksjoner spredt av Mycobacterium Avium Complex hos pasienter med AIDS, for å fortsette behandlingen til kliniske eller mikrobiologiske resultater er oppnådd, og i alle fall etter den behandlende legens skjønn Klaritromycin bør brukes i kombinasjon med andre antimikobakterielle legemidler.
Ved odontostomatologiske infeksjoner er anbefalt dose 250 mg hver 12. time i en varighet på 5 dager.
Doseringsplan for utryddelse av Helicobacter pylori:
Trippel terapi:
Klaritromycin 500 mg to ganger daglig i kombinasjon med omeprazol 20 mg daglig og amoksicillin 1000 mg to ganger daglig i 7 til 10 dager.
Klaritromycin 500 mg to ganger daglig i kombinasjon med lansoprazol 30 mg to ganger daglig og amoksicillin 1000 mg to ganger daglig i 10 dager.
Dobbelterapi:
Klaritromycin 500 mg tre ganger daglig i kombinasjon med omeprazol 40 mg daglig i 14 dager, etterfulgt av omeprazol 20 mg eller 40 mg daglig i ytterligere 14 dager.
Klaritromycin 500 mg tre ganger daglig i kombinasjon med lansoprazol 60 mg daglig i 14 dager. Ytterligere undertrykkelse av syresekresjon kan være nødvendig for reduksjon av sår.
Klaritromycin har også blitt brukt i følgende terapeutiske behandlinger:
• klaritromycin + tinidazol og omeprazol eller lansoprazol
• klaritromycin + metronidazol og omeprazol eller lansoprazol
• klaritromycin + tetracyklin, subsalicylatvismut og ranitidin
• klaritromycin + amoksicillin og lansoprazol
• klaritromycin + ranitidin vismutsitrat
Fremstilling av den orale suspensjonen i doseposer:
For å forberede suspensjonen i doseposer, hell innholdet i posen på et tidspunkt på administrering i et glass vann. Rist til en homogen suspensjon er oppnådd.
Bruk av Klacid -belagte tabletter hos barn under 12 år er ikke undersøkt.
Klacid RM 500 mg tabletter med modifisert frigjøring:
Den anbefalte dosen Klacid RM 500 mg tabletter med modifisert frigjøring til voksne og barn over 12 år er 1 tablett per dag som skal tas med måltider.
Ved mer alvorlige infeksjoner kan dosen økes til 2 500 mg tabletter med modifisert frisetting per dag for å tas som en enkelt dose.
Tablettene skal svelges hele.
Vanlig behandlingstid er 5 til 14 dager, eksklusiv behandling for pneumoni og bihulebetennelse i samfunnet som tar 6 til 14 dager.
Pasienter med nedsatt nyrefunksjon: hos pasienter med nyreinsuffisiens med en kreatininclearanceverdi under 30 ml / min, bør dosen av klaritromycin halveres, f.eks. 250 mg en gang daglig, eller 250 mg to ganger daglig ved alvorlige infeksjoner. Hos disse pasientene bør behandlingen ikke fortsette i mer enn 14 dager. Siden tabletten ikke kan deles og 500 mg daglig dose ikke kan reduseres, bør tabletten med modifisert frigjøring ikke administreres til denne pasientpopulasjonen (se pkt. 4.3).
Bruk av Klacid modifiserte utgivelsestabletter hos barn under 12 år er ikke undersøkt.
Klacid 125 mg / 5 ml Granulat til oral suspensjon og Klacid 250 mg / 5 ml Granulat til oral suspensjon:
Kliniske studier har blitt utført ved administrering av klaritromycinbasert pediatrisk suspensjon til barn fra 6 måneder til 12 år. Følgelig bør barn under 12 år ta den pediatriske suspensjonen (granulat for oral suspensjon).
Den anbefalte daglige dosen til barn er 7,5 mg / kg som skal administreres to ganger daglig for ikke-mykobakterielle infeksjoner.
Vanlig behandlingstid er 5 - 10 dager, avhengig av patogenene som er involvert og alvorlighetsgraden av situasjonen.
Suspensjonen kan tas samtidig med måltider og på tom mage og kan svelges med melk.
Doseringsplan Klacid 125 mg / 5 ml granulat til oral suspensjon
Bruker teskjeen
Doseringsplan Klacid 125 mg / 5 ml granulat til oral suspensjon
Bruk av doseringssprøyten for enkelt administrering
(Aspirer suspensjonen opp til det tilsvarende kg -merket)
Doseringsplan Klacid 250 mg / 5 ml granulat til oral suspensjon
Bruker teskjeen
Doseringsplan Klacid 250 mg / 5 ml granulat til oral suspensjon
Bruk av doseringssprøyten for enkelt administrering
(Aspirer suspensjonen opp til det tilsvarende kg -merket)
Tilberedning av den orale suspensjonen i flaske:
For å forberede Klacid suspensjon:
• tilsett vann til granulatene i flasken opp til den røde linjen på flasken.
• Riste godt.
• Tilsett mer vann for å bringe det tilbake til linjen.
Suspensjonen som er fremstilt slik har en konsentrasjon lik 5% for Klacid 250 mg / 5 ml granulat for oral suspensjon og 2,5% for Klacid 125 mg / 5 ml granulat for oral suspensjon og kan lagres ved romtemperatur (15 ° C - 30 ° C) i 14 dager.
Rist godt før hver bruk.
Bruk doseringssprøyten
• Skru av lokket på flasken.
• Sett sprøyten på flaskehalsen med den spesielle adapteren.
• Trekk ut ønsket dose som er angitt på doseringsskalaen, og administrer etter at du kun har tatt ut sprøyten. La deretter adapteren være satt inn, og skru lokket tilbake på flaskehalsen.
Dosen bør velges ved hjelp av skalaen på sprøyten, opp til den tilsvarende kroppsvekten til barnet.
Klacid 500 mg / 10 ml Pulver og væske til infusjonsvæske, oppløsning:
Anbefalt dose hos voksne pasienter over 18 år er 4-8 mg / kg / dag i to daglige administrasjoner.
Tilberedningen av oppløsningen som skal injiseres skjer ved oppløsning av pulveret i løsningsmidlet og den påfølgende fortynningen i 5% glukose eller fysiologisk løsning, til en sluttkonsentrasjon på 1-2 mg / ml er nådd.
Det er imidlertid tilrådelig å ikke overskride maksimal dose på 1 g ved to daglige administrasjoner.
Det rekonstituerte produktet må brukes innen 24 timer.
Ikke bruk saltoppløsninger som løsningsmiddel. Injiser veldig sakte.
Administrasjonen bør fortsette, avhengig av alvorlighetsgraden av infeksjonen, i opptil 6-14 dager.
Pasienter med nedsatt nyrefunksjon: hos pasienter med nyreinsuffisiens der kreatininclearance er mindre enn 30 ml / min, bør dosen reduseres til det halve.
Hos slike pasienter bør administrasjonen ikke fortsette utover 14 dager.
Det er utilstrekkelige data tilgjengelig for å anbefale en dosering for bruk av klaritromycin IV hos pasienter under 12 år (se "Klacid 125 mg / 5 ml granulat til oral suspensjon og Klacid 250 mg / 5 ml granulat til oral suspensjon") .
Hos barn mellom 12 og 18 år er doseringen den samme som hos voksne.
04.3 Kontraindikasjoner
• Overfølsomhet overfor antibiotika i makrolidklassen eller overfor noen av hjelpestoffene listet opp i pkt. 6.1.
• Samtidig administrering av klaritromycin med et av følgende legemidler: astemizol, cisaprid, pimozid og terfenadin, ettersom de kan indusere forlengelse av QT -intervallet og hjertearytmier, inkludert ventrikulær takykardi, ventrikkelflimmer og torsade de pointes (se avsnitt 4.5).
• Samtidig administrering av klaritromycin med ticagrelor eller ranolazin.
• Samtidig administrering av klaritromycin og ergotalkaloider (ergotamin eller dihydroergotamin), da dette kan føre til ergotoksisitet (se pkt. 4.5).
• Samtidig administrering av klaritromycin og midazolam til oral bruk (se pkt. 4.5).
• Klacid må ikke gis til pasienter med tidligere QT -intervallforlengelse eller ventrikulær hjerterytme, inkludert torsades de pointes (se pkt. 4.4 og 4.5).
• Klacid må ikke administreres samtidig med HMG-CoA reduktasehemmere (statiner), som metaboliseres i stor utstrekning av CYP3A4 (lovastatin eller simvastatin), på grunn av økt risiko for myopati, inkludert rabdomyolyse (se pkt. 4.5).
• Klacid må ikke gis til pasienter med hypokalemi (risiko for forlengelse av QT -intervallet).
• Klacid må ikke brukes til pasienter som lider av alvorlig leversvikt forbundet med nyreskade.
• Som med andre potente hemmere av CYP3A4 -enzymet, bør klaritromycin ikke brukes samtidig med kolkisin (se pkt. 4.4 og 4.5).
Siden den daglige dosen på 500 mg ikke kan reduseres, er Klacid tabletter med modifisert frisetting kontraindisert hos pasienter med kreatininclearance under 30 ml / min. Alle andre farmasøytiske former kan brukes for denne pasientgruppen.
04.4 Spesielle advarsler og passende forholdsregler for bruk
Tabletter og poser
Bruk av antibiotikabehandling, for eksempel med klaritromycin, for å behandle infeksjoner med H. pylori det kan forårsake fremveksten av resistente bakterier.
Alle formuleringer
Klaritromycin bør ikke forskrives til gravide uten en "grundig nytte / risiko -vurdering, spesielt i første trimester av svangerskapet (se pkt. 4.6).
Som med andre antibiotika kan langvarig bruk av klaritromycin forårsake superinfeksjoner med resistente bakterier og sopp som krever avbrudd i behandlingen og vedtak av passende behandlinger.
Forsiktighet bør utvises hos pasienter som opplever alvorlig nyreinsuffisiens (se pkt.4.2).
Tilfeller av nedsatt leverfunksjon (se pkt. 4.8) inkludert forhøyede leverenzymer, hepatocellulær skade og / eller kolestatisk hepatitt, med eller uten gulsott, har blitt rapportert ved bruk av klaritromycin. Denne leverdysfunksjonen kan være alvorlig og er vanligvis reversibel. dødelige tilfeller av leversvikt og har vanligvis vært assosiert med alvorlig underliggende sykdom eller samtidig behandling.
Pasienten bør rådes til å avslutte behandlingen og kontakte legen hvis tegn og symptomer på leversykdom som anoreksi, gulsott, mørk urin, kløe eller magesmerter oppstår.
Tilfeller av pseudomembranøs kolitt er rapportert ved bruk av nesten alle antibakterielle midler, inkludert makrolider, alt fra moderat til livstruende. Tilfeller av Clostridium difficile diaré (CDAD) er rapportert. Ved bruk av de fleste antibakterielle midler, inkludert klaritromycin, som kan variere fra moderat diaré til dødelig kolitt. Behandling med antibakterielle midler endrer den normale tarmfloraen, noe som kan føre til overdreven spredning av C. vanskelig. Hos alle pasienter som klager over diaré etter å ha tatt antibiotika, bør tilstedeværelsen av CDAD (Clostridium difficile diaré) evalueres. Disse pasientene bør gjennomgå en nøye medisinsk historie siden CDAD er rapportert å presentere i løpet av de to månedene etter inntak av antibakterielle midler. Derfor bør seponering av klaritromycinbehandling skje uavhengig av terapeutisk indikasjon. En mikrobiell test bør utføres og passende behandling startes. Administrering av antiperistaltiske midler bør unngås.
Siden klaritromycin metaboliseres og utskilles hovedsakelig i leveren, bør det utvises særlig forsiktighet ved administrering av legemidlet til pasienter med nedsatt leverfunksjon, hos personer med moderat eller alvorlig nedsatt nyrefunksjon og hos eldre (over 65 år).
Kolkisin:
Det har vært rapportert etter markedsføring om kolkisintoksisitet ved samtidig bruk av kolkisin og klaritromycin, spesielt hos eldre pasienter, hvorav noen forekom hos pasienter med nedsatt nyrefunksjon. Dødsfall er rapportert hos noen av disse pasientene (se pkt. 4.5) Samtidig administrering av klaritromycin og kolkisin er kontraindisert (se pkt. 4.3).
Forsiktighet anbefales ved samtidig administrering av klaritromycin og triazolobenzodiazepiner, for eksempel triazolam og injiserbart midazolam (se pkt. 4.5).
Forsiktighet anbefales ved samtidig administrering av klaritromycin og andre ototoksiske legemidler, spesielt aminoglykosider. Det er derfor tilrådelig å periodisk overvåke vestibulær og auditiv funksjon under og etter behandling.
På grunn av risikoen for forlengelse av QT -intervallet, bør klaritromycin brukes med forsiktighet hos pasienter med koronarsykdom, alvorlig hjertesvikt, hypomagnesemi, bradykardi (tidligere ventrikulær arytmi (se pkt. 4.3).
Lungebetennelse:
I påvente av den nye motstanden til Streptococcus pneumoniae for makrolider, er det viktig å utføre en følsomhetstest før du foreskriver klaritromycin for behandling av lungebetennelse fra samfunnet. Ved sykehuservervet lungebetennelse bør klaritromycin administreres i kombinasjon med passende ekstra antibiotika.
Hud- og bløtvevsinfeksjoner av mild til moderat intensitet:
Disse infeksjonene er oftest forårsaket av Staphylococcus aureus Og Streptococcus pyogenessom begge kan være resistente mot makrolider. Deretter er det nødvendig å utføre en sensitivitetstest. I tilfeller der beta-laktamantibiotika ikke kan brukes (f.eks. Allergi), er det å foretrekke å bruke andre antibiotika, for eksempel clindamycin. Makrolider spiller for tiden en viktig rolle bare i hud- og bløtvevsinfeksjoner, slik som forårsaket av Corynebacterium minutissimum, acne vulgaris, erysipelas og i situasjoner der penicillinbasert terapi ikke kan etableres.
Ved alvorlige akutte overfølsomhetsreaksjoner som anafylaksi, Stevens-Johnsons syndrom, toksisk epidermal nekrolyse og DRESS syndrom, bør behandling med klaritromycin seponeres umiddelbart og passende behandling vedtas umiddelbart.
Klacid bør brukes med forsiktighet når det gis samtidig med legemidler som er i stand til å indusere CYP3A4 -enzymet (se pkt. 4.5).
Det bør tas hensyn til muligheten for kryssresistens mellom klaritromycin og andre makrolider, linkomycin og klindamycin.
HMG-CoA reduktasehemmere (statiner): Samtidig bruk av klaritromycin og lovastatin eller simvastatin er kontraindisert (se pkt. 4.3). Vær forsiktig ved forskrivning av klaritromycin med andre statiner. Rabdomyolyse er rapportert hos pasienter som tar klaritromycin og statiner. Pasienter bør overvåkes for tegn og symptomer på myopati.
I situasjoner der samtidig bruk av klaritromycin og statiner ikke kan unngås, anbefales det å foreskrive den laveste registrerte dosen statiner.
Bruk av et statin som ikke er avhengig av metabolismen av CYP3A -enzymet (f.eks. Fluvastatin) kan vurderes (se pkt. 4.5).
Orale hypoglykemiske midler / insulin:
Samtidig bruk av klaritromycin og orale hypoglykemiske midler (for eksempel sulfonylurinstoffer) og / eller insulin kan føre til alvorlig hypoglykemi. Tett glukoseovervåking anbefales (se pkt. 4.5).
Orale antikoagulantia:
C "er risikoen for alvorlig blødning og en signifikant økning i internasjonal normalisert ratio (INR) og protrombintid når klaritromycin administreres samtidig med warfarin (se pkt. 4.5)." INR og protrombintid bør overvåkes ofte hos disse pasientene som behandles samtidig med klaritromycin og orale antikoagulantia.
Hjelpestoffer med kjent effekt:
Klacid Granules for oral suspensjon inneholder sukrose. Pasienter med sjeldne arvelige problemer med fruktoseintoleranse, glukose-galaktose malabsorpsjon eller sukras isomaltase-mangel bør ikke ta denne medisinen.
Når du foreskriver Klacid Granules til oral suspensjon til diabetespasienter, bør sukroseinnholdet vurderes.
Klacid Granules for oral suspensjon inneholder også ricinusolje, som kan forårsake magesmerter og diaré.
Klacid RM 500 mg tabletter med modifisert frigjøring inneholder laktose. Pasienter med sjeldne arvelige problemer med galaktoseintoleranse, Lapp-laktasemangel eller glukose-galaktosemalabsorpsjon bør ikke ta denne medisinen.
04.5 Interaksjoner med andre legemidler og andre former for interaksjon
Bruk av følgende medisiner er absolutt kontraindisert på grunn av potensielle alvorlige effekter på grunn av legemiddelinteraksjonen.
Cisaprid, pimozid, astemizol og terfenadin
Forhøyede nivåer av cisaprid er sett hos pasienter som tar samtidig cisaprid og klaritromycin. Samtidig inntak resulterte i forlenget QT -intervall, hjertearytmier inkludert ventrikulær takykardi, ventrikelflimmer og torsades de pointes. Lignende effekter har blitt observert hos pasienter som tar klaritromycin og pimozid samtidig (se pkt. 4.3).
I litteraturen er det rapportert at makrolider endrer metabolismen av terfenadin ved å øke nivåene som noen ganger har vært assosiert med hjertearytmier, for eksempel forlenget QT, ventrikulær takykardi, ventrikkelflimmer og torsades de pointes (se avsnitt 4.3). I en studie på 14 friske frivillige resulterte samtidig administrering av klaritromycin og terfenadin i en to til tre ganger økning i serumnivået av syremetabolitten til terfenadin og en forlengelse av QT-intervallet som ikke førte til noen påviselig klinisk effekt Lignende effekter har vært assosiert med samtidig administrering av astemizol og andre makrolider.
Alkaloider av ergot
Noen rapporter etter markedsføring indikerer at samtidig administrering av klaritromycin og ergotamin eller dihydroergotamin har vært assosiert med akutt ergotoksisitet (ergotisme) preget av vasospasme og iskemi i ekstremiteter og andre vev, inkludert sentralnervesystemet. Samtidig administrering av klaritromycin og ergotalkaloider er kontraindisert (se pkt. 4.3).
HMG-CoA reduktasehemmere (statiner)
Samtidig bruk av klaritromycin og lovastatin eller simvastatin er kontraindisert (se pkt. 4.3) ettersom disse statinene metaboliseres i stor utstrekning av CYP3A4 og samtidig behandling med klaritromycin øker plasmakonsentrasjonen, noe som øker risikoen for myopati, inkludert rabdomyolyse.
Det har vært rapporter om rabdomyolyse hos pasienter som tar klaritromycin samtidig med disse statinene. Hvis behandling med klaritromycin ikke kan unngås, bør behandling med lovastatin eller simvastatin avbrytes under behandlingen.
Vær forsiktig når du foreskriver klaritromycin med statiner. I situasjoner der samtidig bruk av klaritromycin og statiner ikke kan unngås, anbefales det å foreskrive den laveste registrerte dosen statiner Muligheten for å bruke et statin som ikke er avhengig av CYP3A -metabolisme (f.eks. Fluvastatin). Pasienter bør overvåkes for tegn og symptomer på myopati.
Effekter av andre legemidler på klaritromycin
Legemidler som induserer CYP3A (f.eks. Rifampicin, fenytoin, karbamazepin, fenobarbital, johannesurt) kan indusere metabolismen av klaritromycin. Dette fører til subterapeutiske nivåer av klaritromycin med redusert terapeutisk effekt.
I tillegg kan det være nødvendig å overvåke plasmakonsentrasjonene til CYP3A -induktoren, som kan øke på grunn av inhibering av CYP3A av klaritromycin (se også pakningsvedlegget til CYP3A -hemmer administrert). Samtidig administrering av rifabutin og klaritromycin resulterte i en økning i serum -rifabutinnivåer, en reduksjon i serumnivået av klaritromycin forbundet med økt risiko for uveitt.
Følgende medisiner har vært kjent eller mistenkt for å påvirke sirkulasjon av klaritromycinkonsentrasjoner; Det kan være nødvendig å justere dosen av klaritromycin eller muligheten for å bruke alternative terapier kan bli vurdert.
Efavirenz, nevirapin, rifampin, rifabutin og rifapentine
Legemidler som er funnet å være sterke induktorer for cytokrom P450-metabolisme som efavirenz, nevirapin, rifampicin, rifabutin og rifapentin kan akselerere metabolismen av klaritromycin og følgelig senke plasmanivåene av klaritromycin mens plasmanivåene øker. 14-OH-klaritromycin, en metabolitt som også er aktiv fra et mikrobiologisk synspunkt Siden de mikrobiologiske aktivitetene til klaritromycin og 14-OH-klaritromycin er forskjellige for forskjellige bakterier, kan den forventede terapeutiske effekten bli opphevet under administrering samtidig med klaritromycin og enzyminduktorer.
Etravirin
Eksponering for klaritromycin ble redusert med etravirin; konsentrasjonen av den aktive metabolitten, 14-OH-klaritromycin, ble imidlertid økt. Siden 14-OH-klaritromycin reduserte aktiviteten mot Mycobacterium Avium Complex (MAC), kan den generelle aktiviteten mot dette patogenet endres, derfor bør alternativer til klaritromycin vurderes for behandling av MAC.
Flukonazol
Samtidig administrering av flukonazol 200 mg daglig og klaritromycin 500 mg to ganger daglig til 21 friske frivillige resulterte i økninger i gjennomsnittlig minimumsklaritromycinkonsentrasjon (Cmin) og areal under kurven (AUC).) På henholdsvis 33% og 18%. av den aktive metabolitten, 14-OH-klaritromycin, ble ikke signifikant påvirket av samtidig administrering av flukonazol. Ingen dosejustering nødvendig for klaritromycin.
Ritonavir
En farmakokinetisk studie har vist at samtidig administrering av 200 mg ritonavir hver 8. time og 500 mg klaritromycin hver 12. time fører til markert hemming av metabolismen av klaritromycin. En 31% økning i klaritromycin Cmax, en 182% økning i Cmin og en 77% økning i AUC ble observert ved samtidig administrering av ritonavir. Fullstendig inhibering av 14-OH-klaritromycindannelse ble notert. På grunn av det store terapeutiske vinduet for klaritromycin, er ikke dosereduksjon nødvendig hos pasienter med normal nyrefunksjon. Hos pasienter med nedsatt nyrefunksjon og samtidig behandling med ritonavir bør imidlertid følgende dosejustering vurderes: hvis kreatininclearance (CLCR) er mellom 30 og 60 ml / minutt, bør dosen av klaritromycin reduseres med 50%; hos pasienter der CLCR
Lignende dosejusteringer bør vurderes for pasienter med nedsatt nyrefunksjon som administreres ritonavir som en farmakokinetisk forsterker av andre HIV -proteasehemmere, inkludert atazanavir og saquinavir (se toveis legemiddelinteraksjoner nedenfor).
Effekter av klaritromycin på andre legemidler
CYP3A -baserte interaksjoner
Samtidig administrering av klaritromycin, som er kjent for å hemme CYP3A, og et stoff som hovedsakelig metaboliseres av CYP3A, kan være forbundet med økning i legemiddelkonsentrasjoner som kan potensere eller forlenge de terapeutiske og bivirkningene av legemidlet administrert samtidig.
Klaritromycin bør brukes med forsiktighet hos pasienter som får behandling med andre legemidler som antas å være substrater for CYP3A -enzymet, spesielt hvis CYP3A -substratet har en smal sikkerhetsmargin (f.eks. Karbamazepin) og / eller hvis substratet metaboliseres i stor grad av dette enzym.
Dosejusteringer bør vurderes, og når det er mulig, bør serumkonsentrasjoner av legemidler som hovedsakelig metaboliseres av CYP3A overvåkes nøye hos pasienter som får samtidig klaritromycinbehandling.
Legemidler eller legemiddelklasser som er kjent eller antas å bli metabolisert av det samme CYP3A -isozymet er: alprazolam, orale antikoagulantia (f.eks. Warfarin, se pkt. , omeprazol, pimozid, kinidin, rifabutin, sildenafil, simvastatin, sirolimus, takrolimus, terfenadin, triazolam og vinblastin, men denne listen er ikke fullstendig. Andre legemidler som interagerer med en lignende mekanisme gjennom andre isozymer i cytokrom P450 -systemet er fenytoin, teofyllin og valproat.
Antiarytmika
Det er rapportert tilfeller av torsade de pointes etter markedsføring etter samtidig bruk av klaritromycin og kinidin eller disopyramid Under administrering av disse legemidlene samtidig med klaritromycin er det nødvendig å overvåke det elektrokardiografiske sporet for å påvise tilstedeværelsen av QT-intervallforlengelse. konsentrasjoner av kinidin og disopyramid under bruk i klaritromycinbehandling.
Det har vært rapporter om hypoglykemi etter markedsføring etter samtidig administrering av klaritromycin og disopyramid. Derfor bør blodsukkernivået overvåkes under samtidig administrering av klaritromycin og disopyramid.
Orale hypoglykemiske midler / insulin
Ved samtidig bruk av klaritromycin med visse hypoglykemiske legemidler som nateglinid og repaglinid, kan hemming av CYP3A -enzymet av klaritromycin forekomme og kan forårsake hypoglykemi. Det anbefales å følge nøye med på glukosenivået.
Omeprazol
Friske voksne personer fikk klaritromycin (500 milligram hver 8. time) i kombinasjon med omeprazol (40 milligram daglig). Plasmakonsentrasjonen av omeprazol ved baseline ble økt (Cmax, AUC0-24 og T1 / 2 økes med 30%, 89% og 34 henholdsvis % på grunn av samtidig administrering av klaritromycin.
Gjennomsnittlig gastrisk pH -verdi over 24 timer var 5,2 når omeprazol ble administrert alene, og var 5,7 når omeprazol ble administrert samtidig med klaritromycin.
Sildenafil, tadalafil og vardenafil
Hver av disse fosfodiesterasehemmerne metaboliseres, i det minste delvis, av CYP3A og CYP3A kan hemmes ved samtidig administrering av klaritromycin. Samtidig administrering av klaritromycin og sildenafil, tadalafil eller vardenafil vil med stor sannsynlighet føre til økt eksponering for fosfodiesterasehemmeren. Derfor bør en reduksjon i dosen av sildenafil, tadalafil og vardenafil vurderes når disse legemidlene administreres samtidig med klaritromycin.
Teofyllin, karbamazepin
Resultater av kliniske studier har vist at plasmanivåene av karbamazepin og teofyllin kan gjennomgå en beskjeden, men statistisk signifikant (p≤0,05) økning når disse administreres samtidig med klaritromycin. En dosereduksjon kan være nødvendig.
Tolterodina
Den viktigste metabolske veien for tolterodin passerer gjennom 2D6 -isoformen til cytokrom P450 (CYP2D6), men i en populasjonsundermengde uten CYP2D6 er den identifiserte metabolske veien CYP3A. I denne populasjonsundergruppen, hemmer CYP3A. . I nærvær av CYP3A -hemmere kan en dosereduksjon av tolterodin være nødvendig, samt en dosereduksjon av klaritromycin i pasientpopulasjonen der CYP2D6 metaboliseres dårlig.
Triazolobenzodiazepiner (f.eks. Alprazolam, midazolam, triazolam)
Når midazolam ble administrert samtidig med klaritromycintabletter (500 mg to ganger daglig), ble AUC for midazolam 2,7 ganger høyere etter intravenøs administrering av midazolam og 7 ganger etter intravenøs administrering av midazolam. Administrering av oral midazolam Samtidig administrering av oral midazolam og klaritromycin I tilfelle det kreves intravenøs midazolam samtidig med klaritromycin, bør pasienten overvåkes nøye for dosejustering De samme forholdsreglene bør tas i nærvær av andre benzodiazepiner som metaboliseres av CYP3A, inkludert triazolam og alprazolam. Når det gjelder benzodiazepiner hvis eliminering ikke er avhengig av CYP3A (temazepam, nitrazepam, lorazepam), er det ikke sannsynlig at det er en klinisk viktig interaksjon med klaritromycin.
Legemiddelinteraksjoner og effekter på sentralnervesystemet (CNS) (f.eks. Søvnighet og forvirring) er rapportert etter markedsføring med samtidig bruk av klaritromycin og triazolam. Det er tilrådelig å overvåke pasienten for å holde kontroll over de potensielle farmakologiske effektene som dette kan bestemme på sentralnervesystemet.
Andre legemiddelinteraksjoner
Aminoglykosider
Det bør utvises forsiktighet ved samtidig administrering av klaritromycin med andre ototoksiske legemidler, spesielt med aminoglykosider (se pkt. 4.4).
Kolkisin
Kolkisin er et substrat for både CYP3A og "efflux transportør, P-glykoprotein (Pgp). Klaritromycin og andre makrolider er kjent for å hemme CYP3A og Pgp. Når klaritromycin og kolkisin administreres samtidig, kan inhibering av CYP3A og / eller Pgp av klaritromycin føre til økt eksponering for kolkisin. Overvåke pasientene for kliniske symptomer på kolkisintoksisitet (se pkt. 4.4).
Digoksin
Digoksin antas å være et substrat for avløpstransportøren, P-glykoprotein (Pgp) .Klaritromycin hemmer Pgp. Når digoksin og klaritromycin administreres samtidig, kan hemming av Pgp være noe av klaritromycin kan føre til økt eksponering av digoksin. Økninger i Plasmakonsentrasjoner av digoksin er også rapportert under overvåking etter markedsføring hos pasienter som samtidig får behandling med digoksin og klaritromycin. Noen pasienter har vist lignende kliniske tegn. Plasmakonsentrasjoner av digoksin bør overvåkes nøye mens pasienter får samtidig behandling med digoksin og klaritromycin.
Zidovudine
Samtidig administrering av klaritromycintabletter og zidovudin til voksne pasienter med HIV -infeksjoner kan resultere i en reduksjon i steady state zidovudinkonsentrasjon. Siden klaritromycin ser ut til å forstyrre absorpsjonen av samtidig administrert oralt administrert zidovudin, kan denne interaksjonen sterkt unngås ved å forskyve dosene klaritromycin og zidovudin for å gi et intervall på minst 4 timer. Denne interaksjonen vises ikke hos pediatriske pasienter med HIV infeksjoner. når klaritromycin tas i granulær form samtidig med zidovudin eller didanosin Denne interaksjonen er usannsynlig når klaritromycin administreres intravenøst.
Fenytoin og valproat:
Det har vært spontane eller publiserte rapporter om interaksjoner mellom CYP3A -hemmere, inkludert klaritromycin, med legemidler som ikke anses å metaboliseres av CYP3A (f.eks. Fenytoin og valproat). Serumnivåbestemmelser anbefales for disse legemidlene når de administreres samtidig med klaritromycin. Tilfeller av forhøyede serumnivåer er rapportert.
Toveis legemiddelinteraksjoner
Atazanavir
Klaritromycin og atazanavir er både substrater og hemmere av CYP3A, og det er tegn på toveis legemiddelinteraksjon mellom disse legemidlene. Samtidig administrering av klaritromycin (500 mg to ganger daglig) og atazanavir (400 mg én gang daglig) resulterte i en 2 ganger økning i eksponeringen til klaritromycin og en 70% reduksjon i eksponering for 14-OH-klaritromycin med en 28% økning i AUC for atazanavir. På grunn av klaritromycins store terapeutiske vindu, er det ikke nødvendig med dosereduksjon hos pasienter med normal nyrefunksjon. For pasienter med moderat nyreinsuffisiens (hvor kreatininclearance er 30 til 60 ml / min), bør dosen av klaritromycin reduseres med 50%. Kreatinin er mindre enn 30 ml / min, bør dosen av klaritromycin reduseres med 75%ved bruk av en passende klaritromycinformulering. Administrering av doser av klaritromycin større enn 1000 mg daglig i forbindelse med administrering av proteasehemmere anbefales ikke.
Kalsiumkanalblokkere
Forsiktighet utvises ved samtidig administrering av klaritromycin og kalsiumkanalblokkere som metaboliseres av CYP3A4 (f.eks. Verapamil, amlodipin, diltiazem) på grunn av risikoen for hypotensjon. Plasmakonsentrasjoner av klaritromycin så vel som for kalsiumkanalblokkere kan øke på grunn av interaksjonen.Hypotensjon, bradyarytmi og melkesyreacidose er observert hos pasienter som tar klaritromycin og verapamil samtidig.
Itrakonazol
Klaritromycin og itrakonazol er både substrater og hemmere av CYP3A, noe som resulterer i en toveis legemiddelinteraksjon mellom disse legemidlene. Klaritromycin kan forårsake en økning i plasmanivåer av itrakonazol mens itrakonazol kan øke plasmanivået av klaritromycin. Pasienter som tar klaritromycin og itrakonazol samtidig, bør overvåkes nøye for tegn og symptomer på potensering og forlengelse av de farmakologiske effektene av disse legemidlene.
Saquinavir
Clarithromycin og saquinavir er både substrater og hemmere av CYP3A, noe som resulterer i en "toveis legemiddelinteraksjon mellom disse legemidlene. Samtidig administrering av klaritromycin (500 mg to ganger daglig) og saquinavir (myke gelatinkapsler, 1200 mg tre ganger daglig) hos 12 friske frivillige resulterte i saquinavir AUC- og Cmax -verdier som var 177% og 187% høyere enn de som ble sett med saquinavir monoterapi. AUC- og Cmax -verdiene for klaritromycin var omtrent 40% høyere enn de som ble sett da klaritromycin monoterapi ble administrert. Ingen dosejustering er nødvendig når de to legemidlene administreres samtidig i en begrenset periode ved dosene / formuleringene som er undersøkt. Observasjoner fra legemiddelinteraksjonsstudier utført ved bruk av den myke gelatinkapselformuleringen er kanskje ikke representative for effektene man ser ved bruk av saquinavir hard gelatin kapselformulering. Observasjoner fra legemiddelinteraksjonsstudier utført med saquinavir alene er ikke nødvendigvis representative for effektene som ble sett med kombinasjonsterapi med saquinavir / ritonavir. Når saquinavir administreres samtidig med ritonavir, bør det tas nøye hensyn til de potensielle effektene ritonavir kan ha på klaritromycin.
04.6 Graviditet og amming
Svangerskap:
Sikkerheten til klaritromycin til bruk hos gravide kvinner er ikke evaluert Basert på resultatene fra studier på mus, rotter, kaniner og aper, kan ikke muligheten for skadelige effekter på embryo-fosterutvikling utelukkes. Følgelig er bruk under graviditet anbefales ikke uten en grundig risiko / nyttevurdering.
Foringstid:
Sikkerheten til klaritromycin for bruk under amming er ikke evaluert. Klaritromycin skilles ut i morsmelk.
04.7 Påvirkning av evnen til å kjøre bil og bruke maskiner
Det er ingen data om effekten av klaritromycin på evnen til å kjøre bil eller bruke maskiner. Risikoen for svimmelhet, svimmelhet, forvirring og desorientering, som kan oppstå etter administrering, må vurderes før pasienten kjører bil eller bruker maskiner.
04.8 Bivirkninger
til. Oppsummering av sikkerhetsprofilen
De hyppigste og vanligste bivirkningene knyttet til klaritromycinbehandling for både voksne og barn er magesmerter, diaré, kvalme, oppkast og smakperversjon. Disse bivirkningene er vanligvis av middels intensitet og er i samsvar med den kjente sikkerhetsprofilen for makrolidantibiotika (se pkt. B i pkt. 4.8).
Det er ingen signifikant forskjell i forekomsten av disse gastrointestinale bivirkningene under kliniske studier mellom pasienter med eller uten eksisterende mykobakterielle infeksjoner.
b. Sammendragstabell over bivirkninger
Tabellen nedenfor oppsummerer bivirkninger rapportert under kliniske studier og etter markedsføring med klaritromycin tabletter med umiddelbar frigjøring, granulat til oral suspensjon, pulver og væske til infusjonsvæske, oppløsning og tabletter med modifisert frigjøring.
Bivirkninger som anses muligens relatert til klaritromycin er rapportert etter organtype og frekvens, i henhold til følgende konvensjon: svært vanlige (≥1 / 10), vanlige (≥1 / 100, ikke kjent (kan ikke estimeres fra tilgjengelige data) * Pseudomembranøs kolitt, erysipelas Agranulocytose, trombocytopeni Anafylaktisk reaksjon, angioødem Psykotisk lidelse, forvirringstilstand, depersonalisering, depresjon, desorientering, hallusinasjon, unormale drømmer, mani Kramper, alder, parosmi, anosorditet, ventrikulær parestesi6 Blødning, 9 hepatocellulær gulsott Stevens-Johnsons syndrom4, toksisk epidermal nekrolyse4, legemiddelutbrudd med eosinofili og systemiske symptomer (DRESS), akne Rabdomyolyse **, 10, myopati Nyresvikt, interstitiell nefritt Økt internasjonalt normalisert forhold7, forlenget protrombintid7, unormal urinfarge
* Siden disse reaksjonene er rapportert frivillig fra en befolkning med en ubestemt størrelse, er det ikke alltid mulig å foreta et sant estimat av frekvensen eller etablere et årsak og virkning-forhold til legemiddeleksponering. Pasienteksponering overstiger en milliard dager pasient behandling med klaritromycin
** I noen av de rapporterte tilfellene av rabdomyolyse ble klaritromycin administrert samtidig med statiner, fibrater, kolkisin eller allopurinol.
1 Bivirkning rapportert kun for pulver og væskeformulering til infusjonsvæske, oppløsning
2 Bivirkning rapportert kun for granulat til oral suspensjon
3 Bivirkning rapportert kun for tablettformulering med umiddelbar frigjøring
4,6,8,9 Se avsnitt a)
5,7,10 Se avsnitt c)
c. Beskrivelse av utvalgte bivirkninger
Flebitt på injeksjonsstedet, smerter på injeksjonsstedet, nålestikk og betennelse på injeksjonsstedet er spesifikke for den intravenøse formuleringen.
I noen av de rapporterte tilfellene av rabdomyolyse ble klaritromycin administrert samtidig med statiner, fibrater, kolkisin eller allopurinol (se pkt. 4.3 og 4.4).
Etter markedsføring har det vært rapporter om legemiddelinteraksjoner og effekter av sentralnervesystemet (CNS) (f.eks. Søvnighet og forvirring) med samtidig bruk av klaritromycin og triazolam. Det foreslås at pasienten overvåkes for økte farmakologiske effekter på CNS-nivå (se avsnitt 4.5).
Sjeldne tilfeller av klaritromycin modifiserte frigivelsestabletter i avføring er rapportert, hvorav de fleste forekom hos pasienter med anatomiske endringer (inkludert ileostomi eller kolostomi) eller gastrointestinale funksjonsforstyrrelser med forkortet gastrointestinal transittid. I flere tilfeller har tablettrester forekommet i forbindelse med diaré. For de pasientene som har opplevd tilstedeværelse av tablettrester i avføringen og ingen forbedring i tilstanden, anbefales det å bytte til en annen formulering av klaritromycin (f.eks. Oral suspensjon) eller et annet antibiotika.
Spesiell populasjon: Bivirkninger hos immunkompromitterte pasienter (se avsnitt e).
d. Pediatriske populasjoner
Kliniske studier har blitt utført ved administrering av klaritromycinbasert pediatrisk suspensjon til barn fra 6 måneder til 12 år. Følgelig bør barn under 12 år ta den pediatriske suspensjonen. Det er utilstrekkelige data tilgjengelig for å anbefale en dosering for bruk av klaritromycin IV hos pasienter under 12 år.
Frekvensen, typen og alvorlighetsgraden av bivirkningene forventes å være sammenlignbare med de som forekommer hos voksne.
Og. Andre spesielle populasjoner
Immunkompromitterte pasienter
Hos AIDS eller immunkompromitterte pasienter behandlet for mykobakterielle infeksjoner med høye doser klaritromycin i lange perioder har det ofte vært vanskelig å skille bivirkninger som muligens er forbundet med administrering av klaritromycin fra humant immunsviktvirus (HIV) eller samtidige sykdomsrelaterte manifestasjoner.
Hos voksne pasienter var de hyppigst rapporterte bivirkningene av pasienter behandlet med totale daglige doser på 1000 mg og 2000 mg klaritromycin: kvalme, oppkast, smakperversjon, magesmerter, diaré, utslett, flatulens, hodepine, forstoppelse, nedsatt hørsel, økt serum Glutamic-Oxaloacetic Transaminase (SGOT) og Serum Glutamic-Pyruvic Transaminase (SGPT). Ytterligere mindre hyppige reaksjoner inkluderer dyspné, søvnløshet og munntørrhet. Forekomsten var sammenlignbar for de pasientene som ble behandlet med 1000 mg og 2000 mg, men var generelt 3 til 4 ganger hyppigere hos de pasientene som får en total daglig dose klaritromycin på 4000 mg.
Hos disse immunkompromitterte pasientene ble evalueringer av laboratorieverdier foretatt ved å analysere disse verdiene utenfor de unormale nivåene som ble ansett som alvorlige for den spesifikke testen (f.eks. Øvre og nedre grenser). Basert på disse kriteriene hadde omtrent 2% eller 3% av pasientene som tok 1000 mg eller 2000 mg klaritromycin daglig ekstremt høy unormal SGOT og SGPT, og ekstremt lavt antall hvite blodlegemer og blodplater. En lavere prosentandel pasienter inkludert i disse to dosegruppene viste også forhøyede BUN -verdier. En litt høyere forekomst av unormale verdier ble observert hos pasienter behandlet med 4000 mg klaritromycin daglig for alle parametere unntatt leukocyttformelen.
Rapportering av mistenkte bivirkninger.
Rapportering av mistenkte bivirkninger som oppstår etter godkjenning av legemidlet er viktig, da det muliggjør kontinuerlig overvåking av nytte / risiko -balansen for legemidlet. Helsepersonell blir bedt om å rapportere alle mistenkte bivirkninger via det nasjonale rapporteringssystemet. "Adresse https: //www.aifa.gov.it/content/segnalazioni-reazioni-avverse.
04.9 Overdosering
Ved høye doser klaritromycin kan gastrointestinale forstyrrelser oppstå.En pasient som lider av bipolar lidelse inntok åtte gram klaritromycin som viste endret mental status, paranoid oppførsel, hypokalemi, hypoksemi. Bivirkninger som oppstår ved overdosering bør behandles med øyeblikkelig eliminering av det ikke -absorberte legemidlet og passende støttende behandlinger. Som med andre makrolider elimineres ikke serumnivået av klaritromycin ved hemodialyse eller peritonealdialyse.
Ved overdosering bør behandling med klaritromycin IV (pulver og væske til infusjonsvæske, oppløsning) avbrytes og alle passende støttende tiltak iverksettes.
05.0 FARMAKOLOGISKE EGENSKAPER
05.1 Farmakodynamiske egenskaper
Farmakoterapeutisk gruppe: Generelle antibakterielle midler for systemisk bruk - Makrolider
ATC -kode: J01FA09
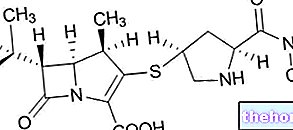
Klaritromycin er et nytt makrolid utviklet av Abbott, som skyldes substitusjon i posisjon 6 i laktonringen av erytromycin i en hydroksylgruppe med CH3O -gruppen.
Det nye makrolidet har vist seg å ha in vitro et antibakterielt spektrum som er aktivt mot de mest kjente og klinisk viktige både Gram -positive og Gram -negative bakteriene, inkludert aerober og anaerober.
Det in vitro antibakterielle spekteret av klaritromycin var som følger: Streptococcus agalactiae, Streptococcus pyogenes, Streptococcus viridans, Streptococcus pneumoniae, Haemophilus influenzae, Haemophilus parainfluenzae, Neisseria gonorrheae, Listeria monocytogenes, Legionella pneumophila, Mycoplasma pneumoniae, Streptococcus plamoniae, Stabacteris acteriumacteriumacteriumacteriumacteriumacteriumacteriumacteriumacteriumis, Mycobacterium avium, Mycobacterium leprae, Mycobacterium intracellulare, Mycobacterium chelonae, Mycobacterium fortuitum og Mycobacterium kansasii.
Virkningen skjer ved å binde seg til 50S ribosomal subenhet, og hemme proteinsyntesen til bakteriecellen.
Pausepunkter
European Committee for Antimicrobial Sensitivity Tests (EUCAST) har etablert følgende bruddpunkter for klaritromycin, separering av følsomme organismer.
Klaritromycin brukes til "utryddelse av"H. pylori: minimum hemmende konsentrasjon (MIC) ≤ 0,25 mcg / ml som er etablert som et følsomhetsbruddspunkt fra Klinisk og Laboratory Standards Institute (C.I.S.I).
05.2 Farmakokinetiske egenskaper
Studier på hunder har vist at etter intravenøs eller oral administrering av 10 mg / kg var det plasmakonsentrasjoner på henholdsvis 3, 2 eller 1 mg / ml etter 1, 4 og 12 timer.
Innen 5 dager etter oral eller intravenøs administrering av (14C) -merket klaritromycin ble omtrent 35-36% av 14C -dosen gjenopprettet som i urinen og omtrent 52% i avføringen.
Klaritromycin metaboliseres i leveren, og den viktigste metabolitten er 14-hydroksy-N-demetylklaritromycin som når maksimal plasmakonsentrasjon på 0,5 mcg / ml og 1,2 mcg / ml etter 2-4 timer etter administrering av 250 og 1200 mg. Først etter oral inntak på 1200 mg ble også lave nivåer av descladinosil-klaritromycin identifisert i plasmaet; den metabolske prosessen har en tendens til metning ved høye doser.
Farmakokinetiske studier på mennesker har vist maksimal plasmakonsentrasjon på 2,08 μg / ml etter oral administrering av 250 mg klaritromycin.
Etter intravenøs administrering av 500 mg klaritromycin oppnås gjennomsnittlige plasmatoppene på 5,52 ± 0,98 mcg / ml.
Halveringstiden til forbindelsen er lik 6,3 timer.
De samme metabolittene som dannes etter oral administrering identifiseres, men i lavere konsentrasjoner, antagelig i forhold til fraværet av en first -pass hepatisk metabolisme.
Modifisert frigivelsesformulering:
Farmakokinetikken til klaritromycin med modifisert frigjøring administrert oralt ble studert hos voksne pasienter og sammenlignet med klaritromycin 250 mg og 500 mg tabletter med umiddelbar frigjøring. Når like totale daglige doser ble administrert, var absorpsjonsgraden ekvivalent. Absolutt biotilgjengelighet er omtrent 50%.
Etter flere doser ble det funnet liten opphopning og stoffskiftet endret seg ikke hos noen arter.
Basert på ekvivalente absorpsjonsresultater, er følgende data for den modifiserte frigjøringsformuleringen gjeldende in vitro og in vivo.
In vitro
utdanning in vitro viste at proteinbinding av klaritromycin i humant plasma i gjennomsnitt er omtrent 70%. ved konsentrasjoner på 0,45 - 4,5 mcg / ml. En reduksjon i binding til 41% ved en konsentrasjon på 45 mcg / ml antyder at bindingsstedene kan bli mettede, men dette skjedde bare ved høye legemiddelkonsentrasjoner langt fra terapeutiske nivåer.
In vivo
I alle vev var klaritromycinkonsentrasjonene, unntatt sentralnervesystemet, mye høyere enn legemiddelkonsentrasjoner i sirkulasjon.
De høyeste konsentrasjonene ble funnet i lever- og lungevevet, hvor vev / plasma -forholdet var 10 til 20.
Den farmakokinetiske oppførselen til klaritromycin er ikke lineær. Hos pasienter som spiste og fikk klaritromycin med modifisert frigjøring 500 mg / dag, var topp plasmakonsentrasjoner av klaritromycin og 14-OH klaritromycin henholdsvis 1,3 mcg / ml og 0,48 mcg / ml. Når dosen ble økt til 1000 mg / dag, var steady-state konsentrasjonsverdiene henholdsvis 2,4 mcg / ml og 0,67 mcg / ml.
Klaritromycin metaboliseres i leveren av cytokrom P450. Tre metabolitter er beskrevet: N-demetyl-klaritromycin; decladinosil-klaritromycin og 14-hydroksyklaritromycin.
Eliminasjonshalveringstiden for klaritromycin og dets aktive metabolitt var henholdsvis 5,3 og 7,7 timer.
Ved høyere konsentrasjoner har den tilsynelatende halveringstiden til både klaritromycin og metabolitten en tendens til å være lengre.
Klaritromycin utskilles via urinen (ca. 40%) og fekalt (ca. 30%).
05.3 Prekliniske sikkerhetsdata
LD50 hos mus og rotter var større enn 5 g / kg oralt og større enn 300 mg / kg oralt hos hunder og aper. Kortsiktig toksisitet (1 måned) viste ingen toksiske effekter, verken på rotter (150 mg / kg / dag) eller på hunder (10 mg / kg / dag). Videre var kronisk toksisitet (3 måneder) 15 mg / kg / dag hos rotter og 10 mg / kg / dag hos hunder.
Mutagenisitetstester har vist at stoffet ikke viser mutagene effekter eller mikrosomal aktivering. Klaritromycin hadde ingen effekt på musens motoriske aktivitet etter oral administrering av 100 mg / kg.
06.0 LEGEMIDDELOPPLYSNINGER
06.1 Hjelpestoffer
• Klacid 250 mg tabletter:
Kroskarmellosenatrium, forgelatinisert stivelse, mikrokrystallinsk cellulose, E-104, silikagel, povidon, stearinsyre, magnesiumstearat, talkum, hypromellose, propylenglykol, sorbitanmonoleat, vanillin, E-171, hydroksypropylcellulose, sorbinsyre.
• Klacid 500 mg tabletter:
Kroskarmellosenatrium, mikrokrystallinsk cellulose, silikagel, povidon, stearinsyre, magnesiumstearat, talkum; beleggsløsning: hypromellose, hydroksypropylcellulose, propylenglykol, sorbitanmonoleat, E-171, sorbinsyre, vanillin, E-104.
• Klacid 125 mg / 5 ml Granulat til oral suspensjon og Klacid 250 mg / 5 ml Granulat til oral suspensjon:
Carbopol 974, povidon, hypromelloseftalat, ricinusolje, silikagel, sukrose, xantangummi, blandet fruktsmak, kaliumsorbat, sitronsyre, titandioksid, maltodextrin, vann.
• Klacid 500 mg / 10 ml pulver og væske til infusjonsvæske, oppløsning:
Laktobionsyre, natriumhydroksid som pH -justerer.
Hvert hetteglass med væske inneholder:
Vann p.p.i.
• Klacid 250 mg granulat til oral suspensjon og Klacid 500 mg granulat til oral suspensjon:
Carbopol 974P, povidon K90, hydroksypropylmetylcelluloseftalat, ricinusolje, silisiumdioksid, maltodekstrin, sukrose, titandioksid, modifisert stivelse, appelsinsmak, glycerisert ammonium, acesulfam K.
• Klacid RM 500 mg tabletter med modifisert utgivelse:
Vannfri sitronsyre, natriumalginat, natrium og kalsiumalginat, laktose, povidon K30, talkum, stearinsyre, magnesiumstearat, hypromellose 6 cps, makrogol 400, makrogol 8000, titandioksid (E -171), sorbinsyre, kinolingult (E - 104).
06.2 Uforlikelighet
Det er for øyeblikket ingen spesifikke uforenligheter med kjente legemidler.
06.3 Gyldighetsperiode
Klacid 250 mg Belagte tabletter 3 år
Klacid 500 mg belagte tabletter 3 år
Klacid 125 mg / 5 ml Granulat til oral suspensjon 2 år
Klacid 250 mg / 5 ml Granulat til oral suspensjon 2 år
Klacid 250 mg Granulat til oral suspensjon 3 år
Klacid 500 mg Granulat til oral suspensjon 3 år
Klacid 500 mg / 5 ml Pulver og væske til infusjonsvæske, oppløsning 3 år
Klacid RM 500 mg tabletter med modifisert frisetting 3 år
06.4 Spesielle forholdsregler for lagring
For pakningen 500 mg granulat til oral suspensjon: Oppbevares ved en temperatur som ikke overstiger 25 ° C.
For pakningsstørrelser 250 mg tabletter, 500 mg tabletter, RM 500 tabletter med modifisert frigjøring, 250 mg granulat til oral suspensjon, 125 mg / 5 ml granulat til oral suspensjon og 250 mg / 5 ml granulat til oral suspensjon: Dette legemidlet gjør krever ingen spesielle oppbevaringsbetingelser.
For pakningen 500 mg / 10 ml pulver og væske til infusjonsvæske, oppløsning: Ingen spesielle forholdsregler for lagring. Det rekonstituerte produktet må brukes innen 24 timer.
06.5 Emballasje og innhold i pakningen
• Klacid 250 mg tabletter:
Kartong med 12 blisterpakninger
• Klacid 500 mg tabletter:
Kartong som inneholder 14-cellers ugjennomsiktig blister
• Klacid RM 500 mg tabletter med modifisert utgivelse:
Kartong som inneholder blisterpakninger med 7 celler
• Klacid 125 mg / 5 ml Granulat til oral suspensjon:
100 ml plastflaske med dispenser
• Klacid 250 mg / 5 ml Granulat til oral suspensjon:
100 ml plastflaske med dispenser
• Klacid 500 mg / 10 ml pulver og væske til infusjonsvæske, oppløsning:
Kartong som inneholder 1 ampull på 500 mg klaritromycin + 1 ampull med løsningsmiddel
• Klacid 250 mg granulat til oral suspensjon:
Kartong som inneholder 14 doser på 250 mg
• Klacid 500 mg granulat til oral suspensjon:
Kartong som inneholder 14 doser på 500 mg
06.6 Bruksanvisning og håndtering
Se avsnitt 4.2
07.0 INNEHAVER AV MARKEDSFØRINGSTILLATELSE
BGP Products S.r.l.
Viale Giorgio Ribotta 11
00144 Roma (RM)
08.0 NUMMER FOR MARKEDSFØRINGSTILLATELSE
Klacid 250 mg belagte tabletter:
Blister 12 tabletter - AIC 027370055
Klacid 500 mg belagte tabletter:
Blister 14 tabletter - AIC 027370129
Klacid 125 mg / 5 ml Granulat til oral suspensjon:
100 ml flaske - AIC 027370067
Klacid 250 mg / 5 ml Granulat til oral suspensjon:
100 ml flaske - AIC 027370117
Klacid 250 mg Granulat til oral suspensjon:
14 poser - AIC 027370093
Klacid 500 mg Granulat til oral suspensjon:
14 poser - AIC 027370105
Klacid 500 mg / 10 ml Pulver og væske til infusjonsvæske, oppløsning:
Flaske + hetteglass med væske - AIC 027370042
Klacid RM 500 mg tabletter med modifisert utgivelse:
Blisterpakning med 7 tabletter à 500 mg modifisert utgivelse - AIC n. 027370143
09.0 DATO FOR FØRSTE GODKJENNELSE ELLER FORNYELSE AV GODKJENNINGEN
Klacid 250 mg tabletter belagt 01/02/1997
Klacid 500 mg Belagte tabletter 06/03/1999
Klacid 125 mg/5 ml Granulat til oral suspensjon 01/02/1997
Klacid 500 mg/10 ml Pulver og væske til infusjonsvæske, oppløsning 01/04/1992
Klacid 250 mg/5 ml Granulat til oral suspensjon 02/04/1999
Klacid 250 mg Granulat til oral suspensjon 17/03/1999
Klacid 500 mg Granulat til oral suspensjon 17/03/1999
Klacid RM 500 mg tabletter med modifisert frigjøring 30/05/2001
AIC fornyelse: 01/06/2010
10.0 DATO FOR REVISJON AV TEKSTEN
Mars 2015